Panoramica
La vaccinazione è uno dei più effettivi interventi nella storia della medicina. Malattie devastanti causate da vari agenti infettivi sono stati completamente o quasi completamente eliminati grazie all’introduzione della pratica vaccinatoria. D’altra parte, ci sono numeri di malattie infettive per le quali i vaccini ancora non esistono. Inoltre, malattie croniche come il cancro stanno ancora aspettando soluzioni valide per trasformare la vaccinazione in un effettivo intervento profilattico e/o terapeutico. 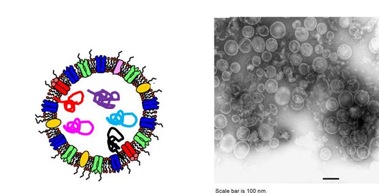
Lo sviluppo dei vaccini contro infezioni recalcitranti e il cancro dipenderanno dall’identificazione di antigeni altamente specifici da formulare con potenti coadiuvanti capaci di suscitare risposte immunitarie efficaci. Il principale obiettivo del nostro laboratorio è creare nuove piattaforme di vaccini basate sullo sfruttamento delle vescicole della membrana esterna (OMVs) naturalmente rilasciate dai batteri Gram-negativi. Per via della capacità intrinseca delle OMV di stimolare potentemente un’innata immunità e grazie alla possibilità delle OMV di essere manipolate con antigeni eterologhi, le vescicole hanno il potenziale di diventare l’impalcatura di vaccini altamente innovativi ed efficaci.
Direzioni di ricerca
Il Laboratorio di vaccinologia sintetica e strutturale è stato istituito nel 2014 quando il ricercatore principale è stato assegnato all’Advanced ERC Grant da parte dell’Unione Europea. Le principali attività di questo laboratorio possono così essere sintetizzate:
- Modifica del genoma di Escherichia coli per creare un nuovo ceppo specializzato nella produzione di OMV
Le OMV trasportano un numero cospicuo di proteine endogene principalmente appartenenti alla membrana esterna e ai compartimenti periplasmici. Si prevede che l’alterazione del repertorio proteico delle OMV possa profondamente influenzare la risposta immunitaria suscitata nei mammiferi sia in termini qualitativi che quantitativi. Si stanno applicando approcci innovativi per la modifica del genoma per rimuovere/aggiungere selettivamente geni e percorsi genetici per creare infine un ceppo E. coli capace di rilasciare un’abbondante quantità di OMV che trasportino un minimo quantitativo di proteine endogene e nuovi componenti immunostimolanti.
- Sviluppo di nuovi strumenti genetici per decorare le OMV con antigeni estranei
L’obiettivo principale di questa attività è trovare strategie di tecnologia genetica per fornire gli antigeni proteici desiderati ai compartimenti OMV. Queste tecnologie includeranno fusioni geniche, ingegneria dei domini e innesto di macchinari di trasporto.
macchinari di trasporto. - Sviluppo di nuovi vaccini basati sulle OMV contro batteri patogeni e cancro
Le OMV vengono decorate con batteri selezionati e antigeni del cancro e immunogenicità e l’attività protettiva delle OMV viene valutata in vitro e in vivo. In particolare, i meccanismi di stimolazione dell’immunità innata vengono analizzati utilizzando linee cellulari ingegnerizzate con specifici Patterns Recognition Receptors (PRR). In aggiunta, la stimolazione degli anticorpi, CD4 e cellule CD8 T verranno valutate in appropriati modelli animali. Infine, i modelli murini per malattie infettive e cancro verranno impostati e utilizzati per stabilire le proprietà protettive dei vaccini basati sulle OMV e per correlare la protezione all’immunità umorale e cellulo-mediata.
Group members
- Guido Grandi, PI
- Laura Fantappiè, assegnista di ricerca
- Francesca Zerbini, assegnista di ricerca
- Carmela Irene, assegnista di ricerca
- Luisa Ganfini, dottoranda
- Michele Tomasi, dottorando
Collaborazioni
- Renata Grifantini, Alberto Grandi, Matteo Parri, Piero Pileri, Susanna Campagnoli, Externautics SpA, Milan, Italy
- Olaf Schneewind, University of Chicago, Chicago, Illinois, USA
- Olivera (Olja) J. Finn, University of Pittsburgh School of Medicine, Pittsburgh, PA, USA
- Rajiv Khanna, QIMR Berghofer, Brisbane, Australia
Pubblicazioni selezionate
F. Bagnoli, M.R. Fontana, E. Soldaini, R.P. Mishra, L. Fiaschi, E. Cartocci, V. Nardi-Dei, P. Ruggiero, S. Nosari, M.G. De Falco, G. Lofano, S. Marchi, B. Galletti, P. Mariotti, M. Bacconi, A. Torre, S. Maccari, M. Scarselli, C.D. Rinaudo, N. Inoshima, S. Savino, E. Mori, S. Rossi-Paccani, B. Baudner, M. Pallaoro, E. Swennen, R. Petracca, C. Brettoni, S. Liberatori, N. Norais, E. Monaci, J. Bubeck Wardenburg, O. Schneewind, D.T. O'Hagan, N.M. Valiante, G. Bensi, S. Bertholet, E. De Gregorio, R. Rappuoli and G. Grandi* (2015). Vaccine composition formulated with a novel TLR7-dependent adjuvant induces high and broad protection against Staphylococcus aureus. Proc Natl Acad Sci U S A. 112:3680-5.
E. Altindis, R. Cozzi, B. Di Palo, F. Necchi, R.P. Mishra, M.R. Fontana, M. Soriani, F. Bagnoli, D. Maione, G. Grandi* and S. Liberatori (2015). Protectome analysis: a new selective bioinformatics tool for bacterial vaccine candidate discovery. Mol Cell Proteomics. 14:418-29.
L. Fantappiè, M. de Santis, E. Chiarot, F. Carboni, G. Bensi, O. Jousson, I. Margarit and G. Grandi* (2014). Antibody-mediated immunity induced by engineered Escherichia coli OMVs carrying heterologous antigens in their lumen. J Extracell Vesicles. 3. doi: 10.3402/jev.v3.24015.
E. Bartolini, E. Ianni, E. Frigimelica, R. Petracca, G. Galli, F. Berlanda Scorza, N. Norais, D. Laera, F. Giusti, A. Pierleoni, M. Donati, R. Cevenini, O. Finco, G. Grandi* and R. Grifantini (2013). Recombinant outer membrane vesicles carrying Chlamydia muridarum HtrA induce antibodies that neutralize chlamydial infection in vitro. J Extracell Vesicles. 2: 20181.
P.R. Dormitzer, G. Grandi and R. Rappuoli (2012) Structural vaccinology starts to deliver. Nat Rev Microbiol. 10:807-813.
O. Finco, E. Frigimelica, F. Buricchi, R. Petracca, G. Galli, E. Faenzi, E. Meoni, A. Bonci, M. Agnusdei, F. Nardelli, E. Bartolini, M. Scarselli, E. Caproni, D. Laera, L. Zedda, D. Skibinski, S. Giovinazzi, R. Bastone, E. Ianni, R. Cevenini, G. Grandi* and R. Grifantini (2011). Approach to discover T and B cell antigens of intracellular pathogens applied to the design of Chlamydia trachomatis vaccines. Proc. Natl. Acad. Sci. U S A. 108:9969-9974.
A. Nuccitelli, R. Cozzi, L.J. Gourlay, D. Donnarumma, F. Necchi, N. Norais, J.L. Telford. R. Rappuoli, M. Bolognesi, D. Maione, G. Grandi* and C.D. Rinaudo (2011). A structure-based approach to rationally design a chimeric protein for an effective vaccine against Group B Streptococcus infections. Proc. Natl. Acad. Sci. U S A. 108:10278-10283.
