Panoramica
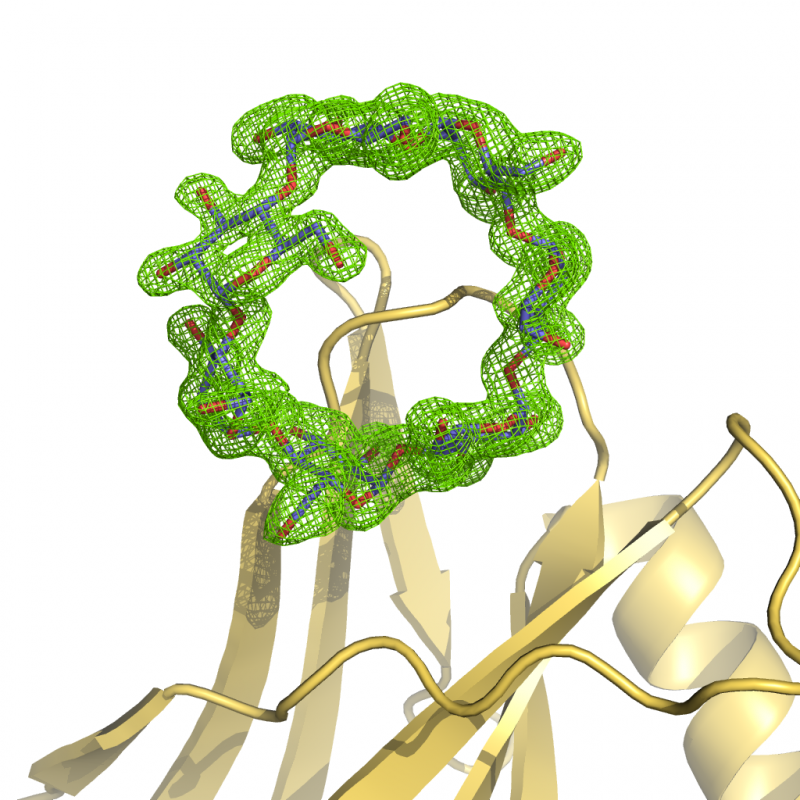
 L'obiettivo principale del laboratorio è determinare le strutture cristallografiche di proteine o complessi proteici con ruolo patogenetico. Questa conoscenza viene poi sfruttata per sviluppare composti chimici volti a sondarne funzione e meccanismi di regolazione nonchè di potenziale interesse farmacologico.
L'obiettivo principale del laboratorio è determinare le strutture cristallografiche di proteine o complessi proteici con ruolo patogenetico. Questa conoscenza viene poi sfruttata per sviluppare composti chimici volti a sondarne funzione e meccanismi di regolazione nonchè di potenziale interesse farmacologico.
Indirizzi di ricerca
-
Bromodomini
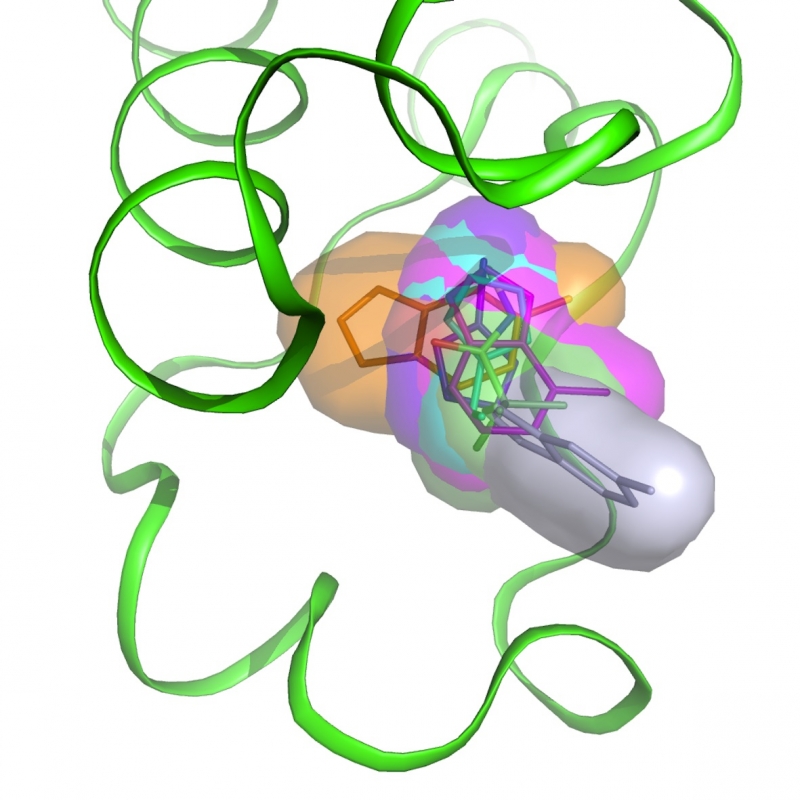 I bromodomini sono moduli proteici che riconoscono le lisine acetilate negli istoni e in altre proteine, regolano la trascrizione e sono coinvolte in varie neoplasie. I membri della sottofamiglia BET sono stati ampiamente studiati negli ultimi anni con 12 inibitori attualmente testati in studi clinici. Per altri bromodomini, lo sviluppo di molecole ad azione farmacologica è ancora in corso. Il nostro interesse è rivolto a BAZ2A, coinvolto in forme aggressive e recidive di tumore prostatico, e BAZ2B, il cui ruolo in malattie neurodegenerative è stato solo recentemente scoperto.
I bromodomini sono moduli proteici che riconoscono le lisine acetilate negli istoni e in altre proteine, regolano la trascrizione e sono coinvolte in varie neoplasie. I membri della sottofamiglia BET sono stati ampiamente studiati negli ultimi anni con 12 inibitori attualmente testati in studi clinici. Per altri bromodomini, lo sviluppo di molecole ad azione farmacologica è ancora in corso. Il nostro interesse è rivolto a BAZ2A, coinvolto in forme aggressive e recidive di tumore prostatico, e BAZ2B, il cui ruolo in malattie neurodegenerative è stato solo recentemente scoperto. -
Domini YTH
I domini YTH sono moduli proteici che riconoscono l’adenosina metilata nell’mRNA, regolandone la stabilità. Inibitori di questi domini aiuterebbero a definire il loro coinvolgimento in vari percorsi fisiologici e patologici. -
CK2
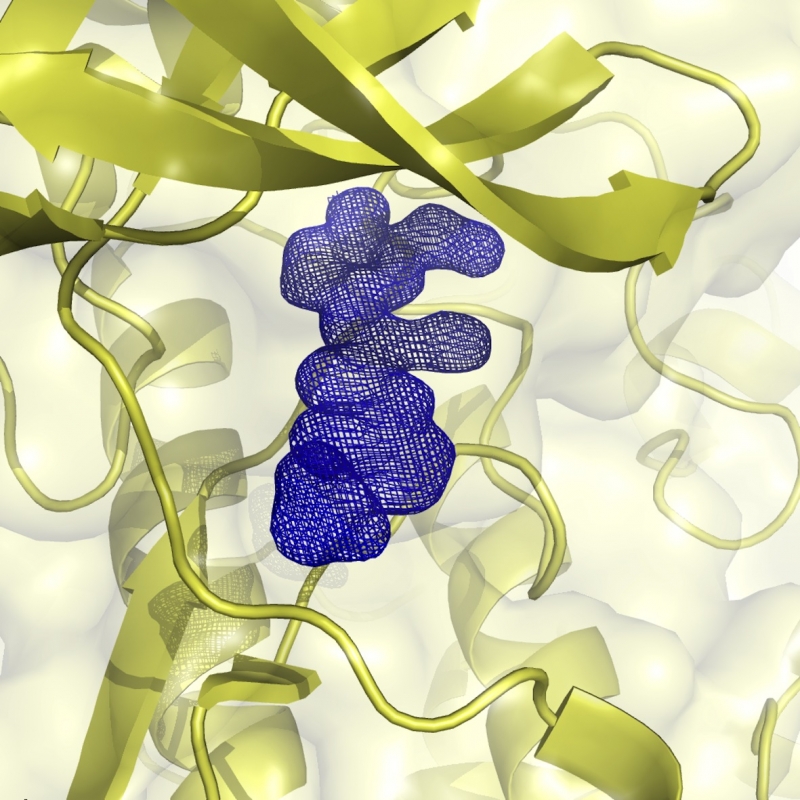 CK2 è una proteina chinasi coinvolta in diversi processi cellulari dall'apoptosi alla differenziazione con elevata attività in vari tumori, in particolare neoplasie ematologiche. Negli ultimi anni sono state sviluppate numerose molecole che interferiscono con l'attività di CK2, culminando nell'inibitore CX-4945, unico finora ad aver intrapreso il percorso della sperimentazione clinica. Il laboratorio è coinvolto nello sviluppo di nuovi inibitori di CK2 con migliorata attività farmacologica.
CK2 è una proteina chinasi coinvolta in diversi processi cellulari dall'apoptosi alla differenziazione con elevata attività in vari tumori, in particolare neoplasie ematologiche. Negli ultimi anni sono state sviluppate numerose molecole che interferiscono con l'attività di CK2, culminando nell'inibitore CX-4945, unico finora ad aver intrapreso il percorso della sperimentazione clinica. Il laboratorio è coinvolto nello sviluppo di nuovi inibitori di CK2 con migliorata attività farmacologica. -
Malattia di Lafora
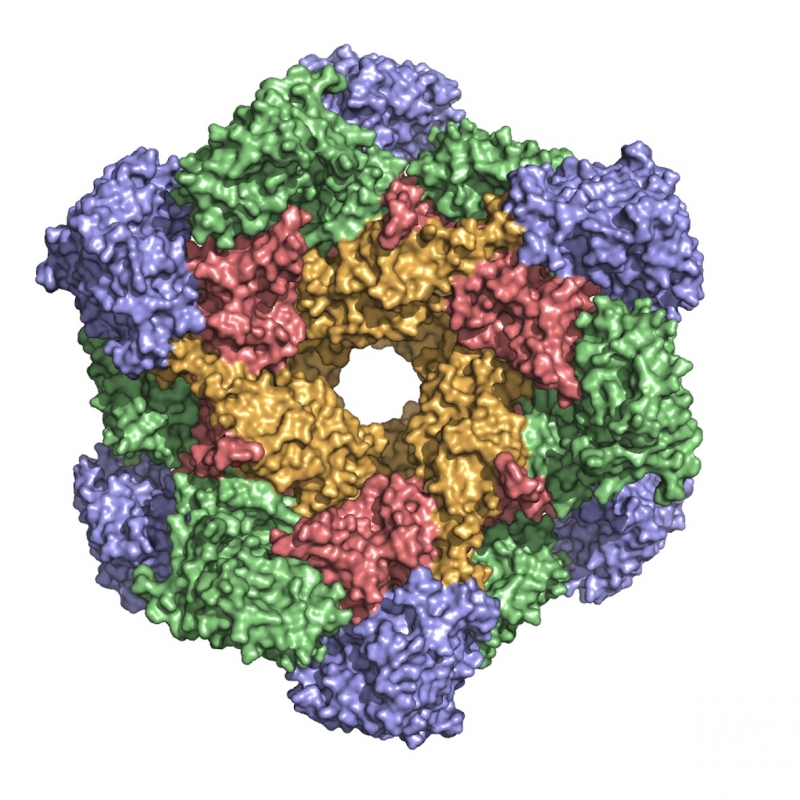
 La malattia di Lafora (LD) è una patologia ad esordio adolescenziale caratterizzata da contrazioni spasmodiche e crisi epilettiche, la cui frequenza aumenta negli anni fino allo stato vegetativo ed alla morte. Al momento, non esistono purtroppo terapie efficaci. Il segno distintivo della LD è la presenza nei neuroni di un accumulo neurotossico di glicogeno insolubile. La dissezione strutturale dei complessi proteici coinvolti nello sviluppo e nella prognosi della LD aiuterebbe a identificare possibili punti di intervento farmacologico da bersagliare successivamente con molecole inibitorie.
La malattia di Lafora (LD) è una patologia ad esordio adolescenziale caratterizzata da contrazioni spasmodiche e crisi epilettiche, la cui frequenza aumenta negli anni fino allo stato vegetativo ed alla morte. Al momento, non esistono purtroppo terapie efficaci. Il segno distintivo della LD è la presenza nei neuroni di un accumulo neurotossico di glicogeno insolubile. La dissezione strutturale dei complessi proteici coinvolti nello sviluppo e nella prognosi della LD aiuterebbe a identificare possibili punti di intervento farmacologico da bersagliare successivamente con molecole inibitorie.
Membri del gruppo
- Graziano Lolli, PI
- Giulia Cazzanelli, assegnista di ricerca
- Andrea Dalle Vedove, assegnista di ricerca
- Gabriele Trentini, dottorando
- Eleonora Parolin, dottorando
Finanziamenti
- Alzheimer’s Association NTF grant 2022-2024
- My First AIRC Grant 2018-2022
Collaborazioni
- Prof. Amedeo Caflisch, Università di Zurigo, Svizzera
- Prof. Alessandro Quattrone, Alessandro Provenzani, Vito Giuseppe D’Agostino, Luca Fava, Ines Mancini, Università di Trento, Italia
- Dr. Paola Storici, Elettra Synchrotron, Trieste, Italia
- Dr. Orazio Palumbo, Fondazione IRCCS Casa Sollievo della Sofferenza, San Giovanni Rotondo, Italia
- Dr. Giuseppe d’Orsi, Ospedali Riuniti and Università di Foggia, Italia
- Prof. Maria Letizia Barreca, Università di Perugia, Italia
- Dr. Gabriele Giachin, Università di Padova, Italia
Pubblicazioni selezionate
Dalle Vedove A., Cazzanelli G., Corsi J., Sedykh M., D’Agostino V.G., Caflisch A. and Lolli G. (2021) Identification of a BAZ2A bromodomain hit compound by fragment joining. ACS Bio & Med Chem Au. https://doi.org/10.1021/acsbiomedchemau.1c00016
Dalle Vedove A., Zonta F., Zanforlin E., Demitri N., Ribaudo G., Cazzanelli G., Ongaro A., Sarno S., Zagotto G., Battistutta R., Ruzzene M. and Lolli G. (2020) A novel class of selective CK2 inhibitors targeting its open hinge conformation. Eur. J. Med. Chem. 195, 112267.
Dalle Vedove A., Spiliotopoulos D., D'Agostino V.G., Marchand J.R., Unzue A., Nevado C., Lolli G and Caflisch A. (2018) Structural Analysis of Small-Molecule Binding to the BAZ2A and BAZ2B Bromodomains. ChemMedChem 13, 1479-87.
Marchand J.R., Dalle Vedove A., Lolli G. and Caflisch A. (2017) Discovery of Inhibitors of Four Bromodomains by Fragment-Anchored Ligand Docking. J. Chem. Inf. Model. 57, 2584-97.
Spiliotopoulos D., Wamhoff E.C., Lolli G., Rademacher C. and Caflisch A. (2017) Discovery of BAZ2A bromodomain ligands. Eur. J. Med. Chem. 139, 564-72.
Lolli G., Naressi D., Sarno S. and Battistutta R. (2017) Characterization of the oligomeric states of the CK2 α2β2 holoenzyme in solution. Biochem. J. 474, 2405-16.
Marchand J.R., Lolli G. and Caflisch A. (2016) Derivatives of 3-amino-2-methylpyridine as BAZ2B Bromodomain Ligands: in silico Discovery and in crystallo Validation. J. Med. Chem. 59, 9919-27.
Unzue A., Zhao H., Lolli G., Dong J., Zhu J., Zechner M., Dolbois A., Caflisch A. and Nevado C. (2016) The “gatekeeper” residue modulates the binding mode of acetyl indoles to bromodomains. J. Med. Chem. 59, 3087-97.
Lolli G. and Caflisch A. (2016) High-throughput fragment docking into the BAZ2B bromodomain: Efficient in silico screening for X-ray crystallography. ACS Chem. Biol. 11, 800-7.
