Panoramica
Il termine cellule staminali neurali si riferisce alle cellule progenitrici che portano alla formazione di neuroni differenziati o cellule gliali.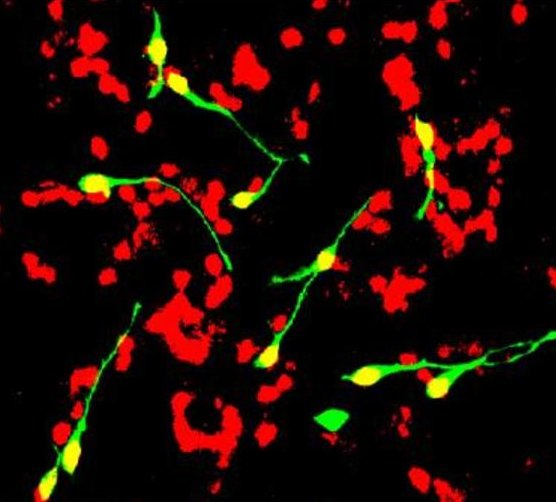 Le cellule staminali neurali sono presenti nel cervello in via di sviluppo e persistono in regioni ristrette del cervello postnatale e adulto. Durante lo sviluppo del cervello, l'equilibrio tra la proliferazione e la differenziazione delle cellule staminali neurali dipende da una delicata interazione tra diversi percorsi. È interessante notare che gli stessi percorsi sono spesso deregolati nei disturbi neurologici e nel cancro al cervello. Un esempio lampante dello stretto legame tra sviluppo e oncogenesi è il Medulloblastoma, il tumore maligno al cervello più diffuso nei bambini. Nei prossimi anni, la mia ricerca si concentrerà sulla comprensione dei meccanismi molecolari e cellulari che regolano le cellule staminali neurali e la biologia dei neuroni durante lo sviluppo del cancro al cervello e nei disturbi neurologici.
Le cellule staminali neurali sono presenti nel cervello in via di sviluppo e persistono in regioni ristrette del cervello postnatale e adulto. Durante lo sviluppo del cervello, l'equilibrio tra la proliferazione e la differenziazione delle cellule staminali neurali dipende da una delicata interazione tra diversi percorsi. È interessante notare che gli stessi percorsi sono spesso deregolati nei disturbi neurologici e nel cancro al cervello. Un esempio lampante dello stretto legame tra sviluppo e oncogenesi è il Medulloblastoma, il tumore maligno al cervello più diffuso nei bambini. Nei prossimi anni, la mia ricerca si concentrerà sulla comprensione dei meccanismi molecolari e cellulari che regolano le cellule staminali neurali e la biologia dei neuroni durante lo sviluppo del cancro al cervello e nei disturbi neurologici.
Indirizzi di ricerca
-
Neurogenesi e biologia delle cellule staminali
Nonostante le cellule staminali neurali siano state ampiamente studiate negli ultimi anni, i meccanismi sottesi alla loro biologia sono ancora scarsamente compresi. Siamo interessati allo studio di come le cellule staminali neurali proliferano e si differenziano durante lo sviluppo del cervello. Per raggiungere questo scopo, utilizziamo una tecnologia all’avanguardia quale quella del tracciamento del lignaggio cellulare, CRISPR/CAS9 e Next Generation Sequencing (NGS). -
Medulloblastoma
Il Medulloblastoma (MB) è il tumore cerebrale più comune che colpisce i bambini e rimane il responsabile di un’alta percentuale di morbilità e mortalità tra i pazienti oncologici. Negli ultimi anni, gli studi sul MB umano e sui modelli murini hanno evidenziato l'esistenza di quattro gruppi principali di MB: WNT, SHH, Gruppo 3 e Gruppo 4. La MB SHH è causata da un guadagno di funzione aberrante della via SHH e si sviluppa nel cervelletto a partire dai precursori dei neuroni granulari (GNP). Decifrare il legame tra sviluppo normale e oncogenesi sarà di fondamentale importanza per comprendere le origini e i meccanismi della oncogenesi cerebrale. Nei prossimi anni sfrutteremo diversi modelli geneticamente modificati in vitro e in vivo per studiare lo sviluppo del Medulloblastoma.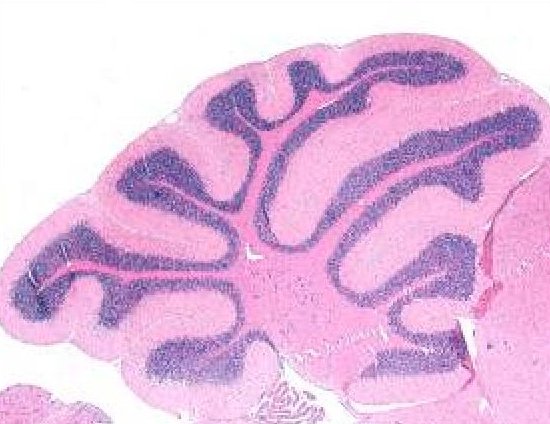
-
Cellule staminali pluripotenti umane indotte (hiPSC) come modello per i disturbi cerebrali
Le cellule neuronali sono state tra i primi tipi di cellule ad essere generate mediante efficienti protocolli di differenziazione da cellule staminali pluripotenti umane indotte (hiPSCs). La differenziazione di hiPSCs da individui sani in cellule neurali permette di investigare e modellare i processi di neurosviluppo umano. Sfrutteremo questa tecnologia per produrre hiPSCs da pazienti con disturbi cerebrali per caratterizzare il modo in cui le cellule staminali neuronali del cervello e/o i neuroni differenziati sono colpiti. Utilizzando hiPSCs avremo modo di studiare come i processi patologici guidino lo sviluppo anormale del cervello umano e/o le malattie degenerative.
Membri del gruppo
- Luca Tiberi, Ricercatore principale
- Matteo Gianesello, dottorando
- Chiara Lago, dottoranda
- Cosimo Sabino, dottorando
- Gloria Leva, Ricercatrice
- Lucrezia Ciccone, Ricercatrice
- Federica Ress, Ricercatrice
Finanziamenti
- 2022, Investigator Grant AIRC
- 2021, EMBO Young Investigator
- 2019, CARITRO Grant
- 2018, My First AIRC Grant
- 2016, Armenise/Harvard Career Development Award
Fondi
Bando: PRIN 2022 (D.D. 104/22)
Patient-derived organoids to model neurodevelopmental ciliopathies
Luca Tiberi, Coordinatore
Codice Protocollo: 2022JT5PWC CUP: E53D23007230006

Pubblicazioni selezionate
Articoli scientifici
Lago C, Gianesello M, Santomaso L, Leva G, Ballabio C, Anderle M, Antonica F, Tiberi L. Medulloblastoma and high-grade glioma organoids for drug screening, lineage tracing, co-culture and in vivo assay. Nat Protoc. 2023 May 29. doi: 10.1038/s41596-023-00839-2. Epub ahead of print. PMID: 37248391.
Antonica F, Santomaso L, Pernici D, Petrucci L, Aiello G, Cutarelli A, Conti L, Romanel A, Miele E, Tebaldi T, Tiberi L. A slow-cycling/quiescent cells subpopulation is involved in glioma invasiveness. Nat Commun. 2022 Aug 15;13(1):4767. doi: 10.1038/s41467-022-32448-0.
G. Aiello, C. Sabino, D. Pernici, M. Audano, F. Antonica, M. Gianesello, A. Quattrone, N. Mitro, A. Romanel, A. Soldano, L. Tiberi. Transient rapamycin treatment during developmental stage extends lifespan in Mus musculus and Drosophila melanogaster. EMBO Reports 2022. doi: 10.15252/embr.202255299.
Ballabio C, Gianesello M, Lago C, Okonechnikov K, Anderle M, Aiello G, Antonica F, Gianno F, Giangaspero F, Hassan B, Pfister S, Tiberi L*. Notch1 switches progenitor competence in inducing medulloblastoma. Science Advances. 2021 Jun 23;7(26):eabd2781. doi: 10.1126/sciadv.abd2781. * Corrisponding author
Ballabio C, Anderle M, Gianesello M, Lago C, Miele E, Cardano M, Aiello G, Piazza S, Caron D, Gianno F, Ciolfi A, Pedace L, Matronuzzi A, Tartaglia M, Locatelli F, Ferretti E, Giangaspero F and Tiberi L*. Modeling Medulloblastoma in vivo and with human cerebellar organoids. Nature Communications. 2020 Feb. doi: 10.1038/s41467-019-13989-3.* Corresponding author
Aiello G, Ballabio C, Ruggeri R, Fagnocchi L, Anderle M, Morassut I, Caron D, Garilli F, Gianno F, Giangaspero F, Piazza S, Romanel A, Zippo A, Tiberi L*. Truncated-Brpf1 cooperates with Smoothened to induce adult Shh Medulloblastoma. Cell Rep. 2019 Dec 17;29(12):4036-4052.e10. doi: 10.1016/j.celrep.2019.11.046. *Corresponding author
Quan, X-J, L. Yuan, L. Tiberi, A. Claeys, N. De Geest, J. Yan, W. R. Xie, T. J. Klisch, R. van der Kant, J. Shymkowitz, Frederic Rousseau, M. Bollen, M. Beullens, H. Y. Zoghbi, P. Vanderhaeghen, B. A. Hassan. “Post-translational control of the temporal dynamics of transcription factor activity regulates neurogenesis”. Cell. 2016 Jan 28;164(3):460-75.
Tiberi L, Bonnefont J, van den Ameele J, Herpoel A, Bilheu A, Baron B, Vanderhaeghen P. “A BCL6/BCoR/Sirt1 complex Triggers Neurogenesis and Suppresses Medulloblastoma by Repressing Sonic Hedgehog Signalling.” Cancer Cell. 2014 Dec 8;26:797-812. FREE FEATURED ARTICLE
Rustighi A*, Zannini A*, Tiberi L, Piazza S, Sorrentino G, Sommaggio R, Rosato A, Santarpia L, Benvenuti F, Nuzzo S, Bicciato S, Aifantis I, Del Sal G. Prolyl-isomerase Pin1 controls normal and cancer stem cells of the breast. EMBO Molecular Medicine. 2014 Jan 1;6(1):99-119. * Equal contribution.
Dimidschstein J, Passante L, Dufour A, van den Ameele J, Tiberi L, Hrechdakian T, Adams R, Klein R, Chichung Lie D, Jossin Y, Vanderhaeghen P. Ephrin-B1 controls the columnar distribution of cortical pyramidal neurons by restricting their tangential migration. Neuron. 2013 Sep 18;79(6):1123-35.
Tiberi L*, van den Ameele J*, Dimidschstein J, Piccirilli J, Gall D, Herpoel A, Bilheu A, Bonnefont J, Iacovino M, Kyba M, Bouschet T, Vanderhaeghen P. BCL6 induces neurogenesis through Sirt1-dependent epigenetic repression of selective Notch transcriptional targets. Nature Neuroscience. 2012 Dec;15(12):1627-35.* Equal contribution.
van den Ameele J*, Tiberi L*, Bondue A*, Paulissen C, Herpoel A, Iacovino M, Kyba M, Blanpain C, Vanderhaeghen P. Eomesodermin induces Mesp1 expression and cardiac differentiation from embryonic stem cells in the absence of Activin. EMBO Reports. 2012 Apr;13(4):355-62. * Equal contribution.
Pietri S, Dimidschstein J, Tiberi L, Sotiropoulou PA, Bilheu A, Goffinet A, Achouri Y, Tissir F, Blanpain C, Jacquemin P, Vanderhaeghen P. Transcriptional Mechanisms of EphA7 Gene Expression in the Developing Cerebral Cortex. Cereb Cortex. 2012 Jul;22(7):1678-89.
Rustighi A*, Tiberi L*, Soldano A, Pece S, Nuciforo P, Capobianco A, Di Fiore P.P. and G. Del Sal. The prolyl-isomerase Pin1 is a Notch1 target that enhances Notch1 activation in cancer. Nature Cell Biology. 2009 Feb;11(2):133-42. * Equal contribution.
Revisioni
Van den Ameele J*, Tiberi L*, Vanderhaeghen P and Espuny-Camacho I*. Thinking out of the dish: what to learn about cortical development using pluripotent stem cells. Trends in Neurosciences. 2014 Apr. 37(6):334-342. * Equal contribution.
Tiberi L, Vanderhaeghen P, van den Ameele J. Cortical neurogenesis and morphogens: diversity of cues, sources and functions. Current Opinion in Cell Biology. 2012 Apr;24(2):269-76.
