Panoramica
L'incidenza del cancro continua ad aumentare costantemente tra la popolazione mondiale ed in questo contesto gli strumenti disponibili per comprendere e trattare questa complessa malattia non riescono a soddisfare la nostra domanda di cura. Potenti modelli animali emergono come una valida alternativa per studiare diversi processi biologici; nel nostro laboratorio la biologia delle cellule maligne, l'evoluzione e il trattamento del cancro possono essere studiati in modo integrato, portandone ad una migliore comprensione ed allo sviluppo di terapie di precisione. Il modello animale zebrafish offre una serie di vantaggi per lo studio della biologia sperimentale del cancro, inclusi il suo rapido sviluppo, la facile manipolazione genetica, l'idoneità per l'imaging in vivo e per lo screening chimico ad alto rendimento. Nello zebrafish il cancro si può sviluppare naturalmente e può anche essere indotto con una varietà di metodi ambientali e genetici, rendendo questo piccolo vertebrato uno strumento straordinario nella ricerca contro il cancro. In effetti, nessun altro modello offre il toolbox genetico, le capacità di imaging e lo screening ad alto rendimento dei farmaci anticancro in un solo minuscolo organismo. Il nostro laboratorio usa lo zebrafish come modello per lo studio della biologia del cancro. Abbiamo sviluppato diversi modelli di cancro che usiamo come fonte di informazioni sulla biologia di diversi tipi di tumore. Possiamo studiare la predisposizione al cancro, l'inizio e la progressione tumorale, le risposte alle terapie e le ricadute nello stesso modello, in una potente piattaforma che ben si adatta agli studi preclinici. Lavoriamo in collaborazione con ricercatori di base e clinici per fornire conoscenze sulla biologia di diversi tipi di tumori che possono essere tradotte in approcci terapeutici a beneficio immediato dei pazienti.
Indirizzi di ricerca
I progetti che realizziamo in laboratorio si basano sui nostri modelli di melanoma cutaneo e oculare e di glioblastoma pediatrico.
- Il ruolo delle vescicole extracellulari nella progressione del melanoma
Le vescicole extracellulari (EV) sono particelle membranose che vengono rilasciate da tutti i tipi di cellule. Il loro ruolo come vettori funzionali di molecole bioattive (ad esempio RNA, DNA, lipidi e proteine) è potenziato nel cancro. Nel nostro laboratorio abbiamo ottimizzato un metodo per l'isolamento e la caratterizzazione di EVs di zebrafish da melanoma. Abbiamo scoperto che le EVs del melanoma inducono una risposta infiammatoria, così come il loro contenuto di RNA non codificante (ncRNA), suggerendo che le esse siano una fonte di ncRNA che può innescare l'infiammazione nelle cellule del microambiente tumorale. Questo progetto mira a identificare le molecole e i meccanismi della progressione tumorale e dell'infiammazione tumorale indotte da EVs.

Figura 1: A. Rappresentazione schematica della micro-dissezione del melanoma, della dissociazione delle singole cellule e dell'isolamento delle EV seguendo il metodo NBI. B. Immagine dal vivo di co-culture di cellule Zmel con EV. Cellule A375 fissate e colorate, in verde (GFP) le zf EVs ed in violetto la proteina mitocondriale mavs.
- I meccanismi alternativi di mantenimento dei telomeri attivano le risposte immunitarie agli acidi nucleici nel glioblastoma
Un gran numero di tumori cerebrali pediatrici ed il 10% di quelli adulti utilizzano Alternative Lengthening of Telomeres (ALT) per mantenere la lunghezza e l’integrità dei telomeri. Un nostro modello di glioblastoma pediatrico in zebrafish riproduce questo meccanismo (Idilli et al., 2020a, b), mostrando un aumento del DNA telomerico extracromosomico (C-Circles) e una maggiore espressione di RNA contenente ripetizioni telomeriche (TERRA). In questo progetto, vogliamo studiare il potenziale di queste diverse specie di acidi nucleici di attivare il sistema immunitario innato, come mezzo per indurre una risposta infiammatoria che sostiene la progressione tumorale e riduce la sopravvivenza dei pazienti pediatrici con cancro al cervello. In collaborazione col laboratorio del professor Cusanelli (link al Laboratorio di Biologia Cellulare e Genetica Molecolare), stiamo investigando il ruolo di TERRA come nuovo bersaglio terapeutico per prevenire l’attivazione di ALT nei tumori al cervello.
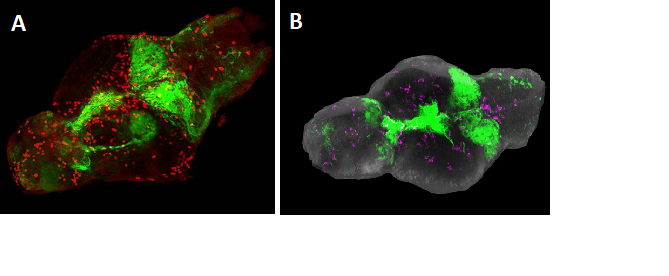
Figura 2: Cervello di zebrafish larvale che esprime l'oncogene GFP-Ras. A. Visualizzazione della fluorescenza di Ras in verde e colorazione (rosso) per fosfo-istone 3 (PH3), che indica le cellule proliferative. B. Microglia (magenta) in cervello di zebrafish con tumore (verde).
-
Melanoma uveale: modelli e metabolismo
Stiamo utilizzando il promotore del gene mitfa per guidare l’espressione dell’oncogene del melanoma uveale GNA11Q209L specificatamente nei melanociti oculari ed abbiamo stabilito un numero di linee di zebrafish che sviluppano precocemente il melanoma uveale quando associate con mutazioni nei geni Bap1, Yap, APC o p53. Siamo interessati nel capire perché melanociti localizzati in diverse posizioni anatomiche siano diversamente suscettibili alla trasformazione cancerogena stimolata da differenti mutazioni oncogeniche, nonostante tutti condividano la stessa origine dalla cresta neurale. Riteniamo che l’ambiente locale possa dettare cambiamenti che influenzano la risposta dei melanociti agli eventi oncogenici attraverso un cambiamento del metabolismo energetico. Stiamo quindi studiando il metabolismo del melanoma uveale in relazione con le diverse mutazioni per identificarecaratteristiche metaboliche che possono essere specificatamente bersagliate per arrestare la progressione tumorale.
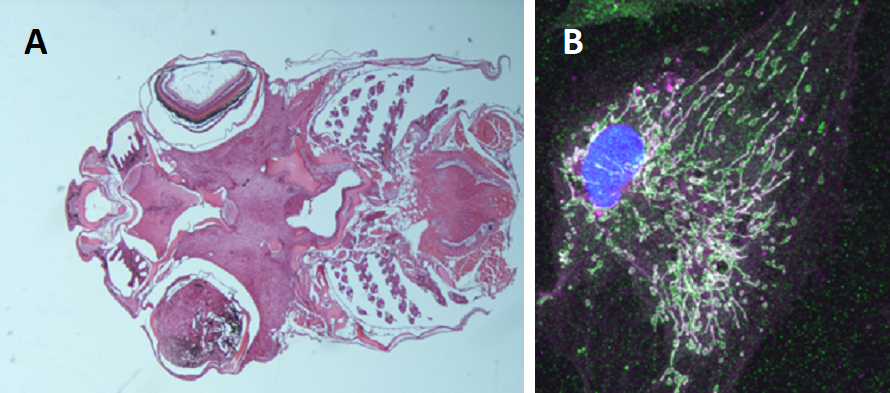
Figure 3: A. Melanoma uveale sviluppato in un modello transgenico di zebrafish che esprime il gene umano GNA11Q209L. B. Esteso network mitocondriale in un melanocita trasformato da una cultura primaria di un tumore con lo stesso genotipo.
Membri del gruppo
- Maria Caterina Mione, PI
- Francesca Lorenzini, ricercatrice postdoc
- Federica Busi, dottoranda
- Irene Pecchini, dottoranda
- Vittorio Bontempi,dottorando
- Claudio Oss Pegorar, dottorando – in collaborazione con il laboratorio “Cell Biology and Molecular Genetics” Lab (CIBIO, PI: Emilio Cusanelli)
- Antonella Calore, Pre-doc
- Alexia Grasso, visiting Post-doc
- Stephanie Marini, studente magistrale
- Giada Mazzurana, studente triennale
Collaborazioni
- Maria L. Cayuela, Hospital Universitario, V. De La Arrixaca-IMIB-FFIS, Murcia, Spagna
- Filippo del Bene, Sorbonne University, Parigi, Francia
- Victor Mulero, University of Murcia, Spagna
- Sergio Roman Roman (Institut Curie, Paris) and the UM Cure Consortium, Francia
- Eirini Trompouki, Institute for Research on Cancer and Aging Nice, University of Côte d' Azur, Francia
- Dirk Sieger, Centre for Neuroregeneration, The University of Edinburgh, U.K.
Pubblicazioni selezionante
Biagini V, Busi F, Anelli V, Kerschbamer E, Baghini M, Gurrieri E, Notarangelo M, Pesce I, van Niel G, D'Agostino VG, Mione M. Zebrafish Melanoma-Derived Interstitial EVs Are Carriers of ncRNAs That Induce Inflammation. Int J Mol Sci. 2022 May 14;23(10):5510. doi: 10.3390/ijms23105510.
Rosello M, Vougny J, Czarny F, Mione MC, Concordet JP, Albadri S, Del Bene F. Precise base editing for the in vivo study of developmental signaling and human pathologies in zebrafish. Elife. 2021 Feb 12;10:e65552. doi: 10.7554/eLife.65552.
Lefkopoulos S, Polyzou A, Derecka M, Bergo V, Clapes T, Cauchy P, Jerez- Longres C, Onishi-Seebacher M, Yin N, Martagon-Calderón NA, Potts KS, Klaeylé L, Liu F, Bowman TV, Jenuwein T, Mione MC, Trompouki E. Repetitive Elements Trigger RIG-I-like Receptor Signaling that Regulates the Emergence of Hematopoietic Stem and Progenitor Cells. Immunity. 2020 Nov 17;53(5):934-951.e9. doi: 10.1016/j.immuni.2020.10.007.
Idilli AI, Pagani F, Kerschbamer E, Berardinelli F, Bernabé M, Cayuela ML, Piazza S, Poliani PL, Cusanelli E, Mione MC*. Changes in the expression of pre-replicative complex genes in hTERT and ALT pediatric brain tumors. Cancers (Basel). 2020 Apr 22;12(4):1028. doi: 10.3390/cancers12041028.
Idilli AI, Cusanelli E, Pagani F, Berardinelli F, Bernabé M, Cayuela ML, Poliani PL, Mione MC*. Expression of tert prevents ALT in zebrafish brain tumors. Front Cell Dev Biol. 2020 Feb 11;8:65. doi: 10.3389/fcell.2020.00065.
Misselbeck K, Parolo S, Lorenzini F, Savoca V, Leonardelli L, Bora P, Morine MJ, Mione MC, Domenici E, Priami C. A network-based approach to identify deregulated pathways and drug effects in metabolic syndrome. Nat Commun. 2019 Nov18;10(1):5215. doi:10.1038/s41467-019-13208-z.
Gómez-Abenza E, Ibáñez-Molero S, García-Moreno D, Fuentes I, Zon LI, Mione MC, Cayuela ML, Gabellini C, Mulero V. Zebrafish modeling reveals that SPINT1regulates the aggressiveness of skin cutaneous melanoma and its crosstalk with tumor immune microenvironment. J Exp Clin Cancer Res. 2019 Sep 13;38(1):405. doi:10.1186/s13046-019-1389-3.
Precazzini F, Pancher M, Gatto P, Tushe A, Adami V, Anelli V, Mione MC*. Automated in vivo screen in zebrafish identifies Clotrimazole as targeting a metabolic vulnerability in a melanoma model. Dev Biol. 2019 Apr 15. pii: S0012-1606(18)30734-6. doi: 10.1016/j.ydbio.2019.04.005.
Zizioli D, Mione M, Varinelli M, Malagola M, Bernardi S, Alghisi E, Borsani G, Finazzi D, Monti E, Presta M, Russo D. Zebrafish disease models in hematology: Highlights on biological and translational impact. Biochim Biophys Acta Mol Basis Dis. 2019 Mar 1;1865(3):620-633. doi: 10.1016/j.bbadis.2018.12.015
Piragyte I, Clapes T, Polyzou A, Klein Geltink RI, Lefkopoulos S, Yin N, Cauchy P, Curtis JD, Klaeylé L, Langa X, Beckmann CCA, Wlodarski MW, Müller P, Van Essen D, Rambold A, Kapp FG, Mione M, Buescher JM, Pearce EL, Polyzos A, Trompouki E. A metabolic interplay coordinated by HLX regulates myeloid differentiation and AML through partly overlapping pathways. Nat Commun. 2018 Aug 6;9(1):3090. doi: 10.1038/s41467-018-05311-4.
Chia K, Mazzolini J, Mione M, Sieger D. Tumor initiating cells induce Cxcr4-mediated infiltration of pro-tumoral macrophages into the brain. Elife. 2018 Feb 21;7. pii: e31918. doi: 10.7554/eLife.31918.
Mayrhofer M, Gourain V, Reischl M, Affaticati P, Jenett A, Joly JS, Benelli M, Demichelis F, Poliani PL, Sieger D, Mione M.* A novel brain tumour model in zebrafish reveals the role of YAP activation in MAPK- and PI3K-induced malignant growth. Dis Model Mech. 2017 Jan 1;10(1):15-28.
Anelli V, Mione M*. Melanoma niche formation: it is all about melanosomes making CAFs. Pigment Cell Melanoma Res. 2016 Oct 23. doi: 10.1111/pcmr.12545.
Puoi trovare una lista completa delle pubblicazioni a questo link.
