
Introduzione
Il cancro è una patologia estremamente diffusa, eterogenea ed ancor oggi troppo spesso letale. Alcune forme di tumore sono associate all'età dell’individuo, o al sesso, altre a fattori ambientali, alcune sono estremamente aggressive, altre indolenti. Tutte indistintamente però hanno una base genetica ed aberrazioni molecolari che le contraddistingue. La definizione dei meccanismi molecolari alla base dei processi neoplastici è un obiettivo cruciale per migliorare le decisioni cliniche, l'efficacia dei trattamenti e, infine, la sopravvivenza dei pazienti. Interesse primario del mio gruppo di ricerca è la generazione di modelli di studio in vitro ed in vivo che ricapitolino le diverse fasi del processo tumorale per comprendere i circuiti molecolari responsabili dell’ insorgenza, aggressività e resistenza ai trattamenti di specifiche patologie tumorali. Tali modelli sono uno strumento indispensabile per l'identificazione di nuovi marcatori degli stadi precoci della malattia, di bersagli terapeutici efficacy, nonché per la valutazione pre-clinica e co-clinica dell’efficacia di nuovi trattamenti oncologici personalizzati.
Indirizzi di ricerca
-
Segnali extracellulari nell'omeostasi e tumorigenesis del tessuto prostatico
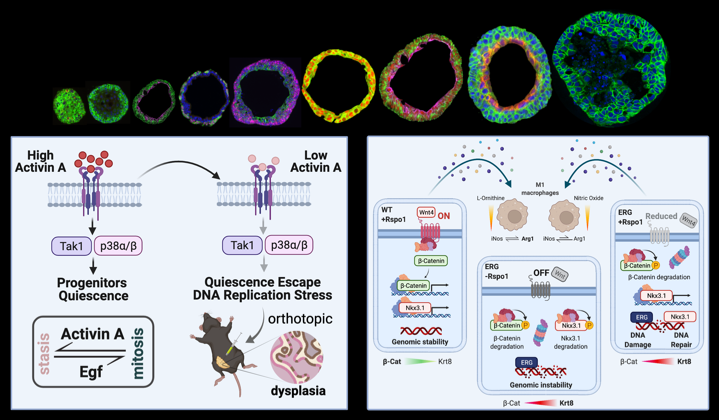
Pochi fattori secreti, soprattutto proteine, sono stati identificati nel carcinoma prostatico umano, la cui rilevanza per l'insorgenza, la progressione e la risposta a trattamenti specifici non è però ben compresa. Il nostro obiettivo consiste nello sfruttare culture di organoidi e linee cellulari cultivate in 2D e 3D per esplorare il ruolo di specifiche molecole secrete nell'omeostasi del tessuto prostatico sano e nella patogenesi del tumore.
(Cambuli, Foletto et al., 2022; Lorenzoni, De Felice et al., 2022). -
Identificazione di nuove terapie a bersaglio che rendano più efficaci i protocolli clinici
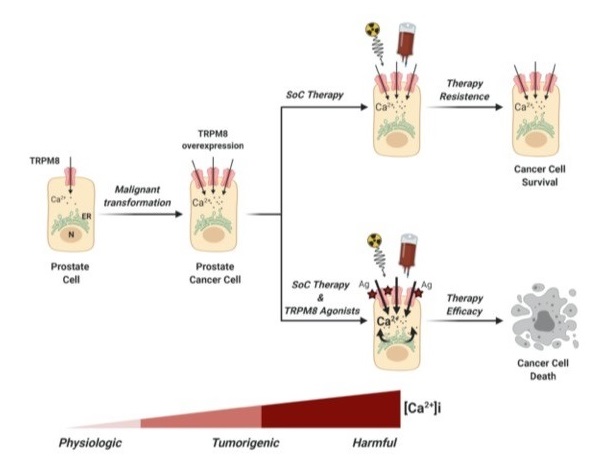
Il nostro Gruppo, insieme ad altri, ha identificato il canale ionico Transient Receptor Potential Cation Channel Melastatin Member 8 (TRPM8) come potenziale candidato per approcci farmacologici di oncologia di precision in diverse forme di tumori solidi. Esperimenti in linee cellulari umane e murine che rispecchiano forme aggressive di diverse tipologie di cancro, hanno dimostrato come il targeting farmacologico di TRPM8 possa migliorare l'efficacia di protocolli oncologici standard. Lo studio preclinico in vivo con soluzioni innovative di somministrazione basate su molecule chimeriche è uno dei prossimi obiettivi del nostro laboratorio.
(Alaimo et al., 2020; Genovesi et al., 2022). -
Stati infiammatori ed immunologia del cancro alla prostataData la ridotta incidenza di mutazioni genetiche, le cellule tumorali della prostata sono scarsamente decorate con neo-antigeni e mal intercettate dal sistema immunitario. Una seconda categoria di epitopi immunogenici è rappresentata dai cosiddetti Tumor Associated Antigens. I TAA possono derivare, ad esempio, da eventi aberranti di splicing dell'RNA, di modifiche post-traduzionali, di degradazione proteica, o dall'espressione ectopica di geni embrionali e germinali. Una delle nuove line di ricerca del laboratorio prevede l'identificazione di TAA immunogenici nonché di nuovi meccanismi in grado di promuovere il reclutamento intratumorale del sistema immunitario. L'obiettivo finale in questo caso è la generazione e la sperimentazione preclinica di vaccini per il trattamento del cancro alla prostata.
Membri del gruppo
- Andrea Lunardi, PI
- Alessandro Alaimo, Senior PostDoc
- Nicole Anesi PreDoc
- Sacha Genovesi, Research Assistant
Riconoscimenti
- 2008- Begnudelli Award, Pezcoller-AACR Foundation, Trento, Italia.
- 2018-Begnudelli Award, Pezcoller-AACR Foundation, Trento, Italia.
- 2014- Career Development Award, The Giovanni Armenise Harvard Foundation.
- 2018-EMBO Molecular Medicine Award-EMBO/EMBL Organoid Symposium.
Finanziamenti
- Armenise/Harvard Career Development Award (Passato)
- MIUR/PRIN 2017 (Attivo)
- Lega Italiana per la Lotta ai Tumori-LILT (Attivo)
- Fondazione Trentina per la Ricerca sui Tumori (Attivo)
- AIRC (Attivo)
Collaboratori
- Nicola Ternette, Nuffield Department of Medicine, University of Oxford, UK.
- Massimo Loda, Weill Cornell Medicine, New York, USA.
- Michael M. Shen, Columbia University New York, USA.
- Marianna Kruithof-de Julio, Bern University, Bern, Switzerland.
- Martin G. Pomper, Johns Hopkins Medicine, Baltimore, USA.
- Alessandro Romanel, Università degli studi di Trento, Trento, Italia.
- Francesca Demichelis, Università degli studi di Trento, Trento, Italia.
- Mattia Barbareschi, Ospedale Santa Chiara, Trento, Italia.
- Orazio Caffo, Ospedale Santa Chiara, Trento, Italia.
- Alberto Briganti, Ospedale San Raffaele, Milano, Italia.
- Claudio Doglioni, San Raffaele Hospital, Milan. Italy.
- Rodolfo Montironi, Ospedali Riuniti, Ancona, Italy.
- Maurizio Taglialatela, University of Naples Federico II, Naples, Italy.
- Valeria Poli, University of Turin, Turin, Italy.
- Marco Gaspari, University of Catanzaro, Catanzaro, Italy.
- Licio Collavin, University of Trieste, Trieste, Italy.
- Giannino Del Sal, ICGEB-University of Trieste, Trieste, Italy.
Pubblicazioni selezionate
Articoli scientifici
Lorenzoni M, De Felice D, Beccaceci G, Di Donato G, Foletto V, Genovesi S, Bertossi A, Cambuli F, Lorenzin F, Savino A, Avalle L, Cimadamore A, Montironi R, Weber V, Carbone FG, Barbareschi M, Demichelis F, Romanel A, Poli V, Del Sal G, Julio MK, Gaspari M, Alaimo A, Lunardi A. 2022 ETS-related gene (ERG) undermines genome stability in mouse prostate progenitors via Gsk3β dependent Nkx3.1 degradation. Cancer Lett. 2022 May 28;534:215612. doi: 10.1016/j.canlet.2022.215612. Epub 2022 Mar 5. PMID: 35259458
Cambuli F, Foletto V, Alaimo A, De Felice D, Gandolfi F, Palumbieri MD, Zaffagni M, Genovesi S, Lorenzoni M, Celotti M, Bertossio E, Mazzero G, Bertossi A, Bisio A, Berardinelli F, Antoccia A, Gaspari M, Barbareschi M, Fiorentino M, Shen MM, Loda M, Romanel A, Lunardi A. 2022 Intra-epithelial non-canonical Activin A signaling safeguards prostate progenitor quiescence. EMBO Rep. 2022 May 4;23(5):e54049. doi: 10.15252/embr.202154049. Epub 2022 Mar 7. PMID: 35253958
Genovesi S, Moro R, Vignoli B, De Felice D, Canossa M, Montironi R, Carbone FG, Barbareschi M, Lunardi A, Alaimo A. 2022 Trpm8 Expression in Human and Mouse Castration Resistant Prostate Adenocarcinoma Paves the Way for the Preclinical Development of TRPM8-Based Targeted Therapies. Biomolecules. 2022 Jan 23;12(2):193. doi: 10.3390/biom12020193.PMID: 35204694
Alaimo A, Lorenzoni M, Ambrosino P, Bertossi A, Bisio A, Macchia A, Zoni E, Genovesi S, Cambuli F, Foletto V, De Felice D, Soldovieri MV, Mosca I, Gandolfi F, Brunelli M, Petris G, Cereseto A, Villarroel A, Thalmann G, Carbone FG, Kruithof-de Julio M, Barbareschi M, Romanel A, Taglialatela M, Lunardi A. 2020 Calcium cytotoxicity sensitizes prostate cancer cells to standard-of-care treatments for locally advanced tumors. Cell Death Dis. Dec 7;11(12):1039. doi: 10.1038/s41419-020-03256-5. PMID: 33288740
Bezzi M, Seitzer N, Ishikawa T, Reschke M, Chen M, Wang G, Mitchell C, Ng C, Katon J, Lunardi A, Signoretti S, Clohessy JG, Zhang J, Pandolfi PP. 2018 Diverse genetic-driven immune landscapes dictate tumor progression through distinct mechanisms. Nat Med. Feb;24(2):165-175. doi: 10.1038/nm.4463. Epub 2018 Jan 8. PMID: 29309058
Lunardi A, Varmeh S, Chen M, Taulli R, Guarnerio J, Ala U, Seitzer N, Ishikawa T, Carver BS, Hobbs RM, Quarantotti V, Ng C, Berger AH, Nardella C, Poliseno L, Montironi R, Castillo-Martin M, Cordon-Cardo C, Signoretti S, Pandolfi PP. 2015. Suppression of CHK1 by ETS family members promotes DNA damage response by-pass and tumorigenesis. Cancer Discov. Feb 4. pii: CD-13-1050. PMID:25653093
Guarnerio J, Riccardi L, Taulli R, Maeda T, Wang W, Hobbs RM, Song MS, Sportoletti P, Bernardi R, Bronson RT, Castillo-Martin M, Cordon-Cardo C, Lunardi A*, Pandolfi PP*. 2015. A genetic platform to model sarcomagenesis from primary adult mesenchymal stem cells. Cancer Discov. 2015 Jan 22. pii: CD-14-1022. PMID: 25614485
Liu XS, Chandramouly G, Rass E, Guan Y, Wang G, Hobbs RM, Rajendran A, Xie A, Shah JV, Davis AJ, Scully R, Lunardi A*, Pandolfi PP*. 2015. LRF maintains genome integrity by regulating the non-homologous end joining pathway of DNA repair. Nat Commun. Oct 8;6:8325. doi: 10.1038/ncomms9325. PMID: 26446488
Papa A, Wan L, Bonora M, Salmena L, Song MS, Hobbs RM, Lunardi A, Webster K, Ng C, Newton RH, Knoblauch N, Guarnerio J, Ito K, Turka LA, Beck AH, Pinton P, Bronson RT, Wei W, Pandolfi PP. 2014. Cancer-associated PTEN mutants act in a dominant-negative manner to suppress PTEN protein function. Cell, 157(3):595-610. PMID:24766807
Wang G*, Lunardi A*, Zhang J, Chen Z, Ala U, Webster KA, Tay Y, Gonzalez-Billalabeitia E, Egia A, Shaffer DR, Carver B, Liu XS, Taulli R, Kuo WP, Nardella C, Signoretti S, Cordon-Cardo C, Gerald WL, Pandolfi PP. 2013. Zbtb7a suppresses prostate cancer through repression of a Sox9-dependent pathway for cellular senescence bypass and tumor invasion. Nat Genet, 45(7):739-46. PMID:23727861
Lunardi A, Ala U, Epping MT, Salmena L, Clohessy JG, Webster KA, Wang G, Mazzucchelli R, Bianconi M, Stack EC, Lis R, Patnaik A, Cantley LC, Bubley G, Cordon-Cardo C, Gerald WL, Montironi R, Signoretti S, Loda M, Nardella C, Pandolfi PP. 2013. A co-clinical approach identifies mechanisms and potential therapies for androgen deprivation resistance in prostate cancer. Nat Genet, 45(7):747-55. PMID:23727860
Revisioni
Alaimo A, De Felice D, Genovesi S, Lorenzoni M, Lunardi A. 2021 Tune the channel: TRPM8 targeting in prostate cancer. Oncoscience. Sep 10;8:97-100. doi: 10.18632/oncoscience.543. eCollection 2021. PMID: 34514058
Rubert J, Schweiger PJ, Mattivi F, Tuohy K, Jensen KB, Lunardi A. 2020 Intestinal Organoids: A Tool for Modelling Diet-Microbiome-Host Interactions. Trends. Endocrinol Metab. Nov;31(11):848-858. doi: 10.1016/j.tem.2020.02.004. PMID: 33086077
Lunardi A, Pandolfi PP. 2014. A co-clinical platform to accelerate cancer treatment optimization. Trends Mol Med. 21(1):1-5. PMID:25466492
Lunardi A, Guarnerio J, Wang G, Maeda T, Pandolfi PP. 2013. Role of LRF/Pokemon in lineage fate decisions. Blood. 121(15):2845-53. PMID:23396304
Nardella C, Lunardi A, Patnaik A, Cantley LC, Pandolfi PP. 2011. The APL paradigm and the "co-clinical trial" project. Cancer Discov. 1(2):108-16. PMID:22116793
Collavin L, Lunardi A, Del Sal G. 2010. p53-family proteins and their regulators: hubs and spokes in tumor suppression. Cell Death Differ. Jun;17(6):901-11. PMID:20379196
Capitoli di libri
Lunardi A, Nardella C, Clohessy JG, Pandolfi PP. 2014. Of model pets and cancer models: an introduction to mouse models of cancer. Cold Spring Harb Protoc. 1; (1):17-31. PMID:24371312
Link
https://pubmed.ncbi.nlm.nih.gov/?term=Lunardi%20Andrea&sort=date
https://lunardilab.wordpress.com
