Panoramica
Studiamo come le cellule comunicano e come i cambiamenti nelle loro vie metaboliche influenzano il comportamento delle cellule vicine. Sfruttando la potenza della genetica della Drosophila e l'elevata flessibilità e disponibilità di strumenti genetici, utilizziamo animali portatori di modelli di malattie umane, tra cui tumori, degenerazione neuronale e disordini metabolici, per analizzare come i cambiamenti nel loro metabolismo possano influenzare la crescita e la sopravvivenza.
Indirizzi di ricerca
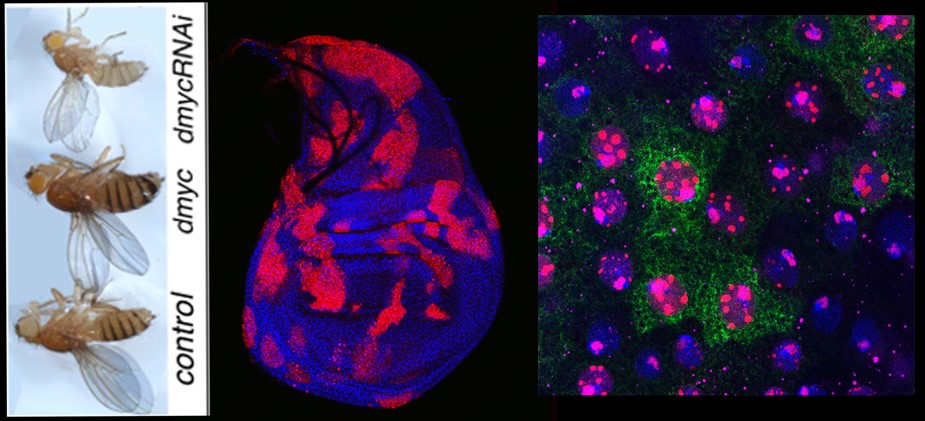 Caratterizzazione della competizione cellulare indotta da MYC e della biogenesi ribosomiale: un legame con la crescita tumorale.Abbiamo dimostrato che diversi livelli di Myc inducono la competizione cellulare, un processo che si verifica quando le cellule "vincitrici" - con livelli maggiori di sintesi proteica e un metabolismo migliore - crescono ed espandono il loro dominio uccidendo attivamente le cellule wild-type o “perdenti”. La competizione cellulare è fondamentale nelle fasi iniziali della tumorigenesi. La disregolazione della biogenesi dei ribosomi e dell'attività traslazionale è associata allo sviluppo e alla progressione del cancro ed è anche un segno distintivo delle ribosomopatie, malattie genetiche rare causate da mutazioni nelle proteine ribosomiali e fattori di processamento dell'rRNA. Utilizzando approcci genetici e proteomici, abbiamo identificato alcuni geni regolati da MYC che controllano la maturazione dell'rRNA o la funzione ribosomiale, come NOC1, un nuovo componente della competizione cellulare indotta da stress nucleolare. Stiamo usando Drosophila per caratterizzare lo stress nucleolare indotto da MYC, per svelare nuovi meccanismi che collegano la biogenesi dei ribosomi, la competizione cellulare e l'inizio del tumore.
Caratterizzazione della competizione cellulare indotta da MYC e della biogenesi ribosomiale: un legame con la crescita tumorale.Abbiamo dimostrato che diversi livelli di Myc inducono la competizione cellulare, un processo che si verifica quando le cellule "vincitrici" - con livelli maggiori di sintesi proteica e un metabolismo migliore - crescono ed espandono il loro dominio uccidendo attivamente le cellule wild-type o “perdenti”. La competizione cellulare è fondamentale nelle fasi iniziali della tumorigenesi. La disregolazione della biogenesi dei ribosomi e dell'attività traslazionale è associata allo sviluppo e alla progressione del cancro ed è anche un segno distintivo delle ribosomopatie, malattie genetiche rare causate da mutazioni nelle proteine ribosomiali e fattori di processamento dell'rRNA. Utilizzando approcci genetici e proteomici, abbiamo identificato alcuni geni regolati da MYC che controllano la maturazione dell'rRNA o la funzione ribosomiale, come NOC1, un nuovo componente della competizione cellulare indotta da stress nucleolare. Stiamo usando Drosophila per caratterizzare lo stress nucleolare indotto da MYC, per svelare nuovi meccanismi che collegano la biogenesi dei ribosomi, la competizione cellulare e l'inizio del tumore.-
Fratassina e ferroptosi: nuovi modelli di atassia di Friedreich (FA) in Drosophila.
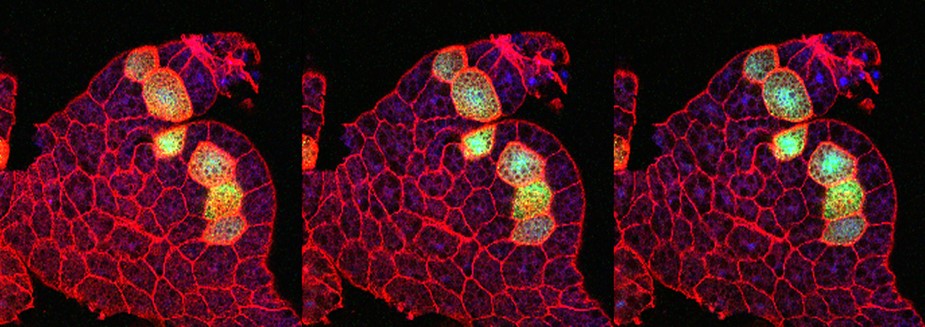 L'atassia di Friedreich (FRDA) è una malattia genetica causata dal ridotto livello di fratassina. Il metabolismo del ferro e la funzione della fratassina sono altamente conservati tra Drosophila e vertebrati, permettendoci di generare modelli di fratassina di Drosophila con diversi fenotipi correlati a FRDA. Stiamo usando questi diversi modelli di FA in Drosophila per definire meglio la segnalazione della ferroptosi in diversi organi e per testare farmaci che potrebbero migliorarla, per completare in seguito questi studi usando modelli di organoidi 3D da pazienti.
L'atassia di Friedreich (FRDA) è una malattia genetica causata dal ridotto livello di fratassina. Il metabolismo del ferro e la funzione della fratassina sono altamente conservati tra Drosophila e vertebrati, permettendoci di generare modelli di fratassina di Drosophila con diversi fenotipi correlati a FRDA. Stiamo usando questi diversi modelli di FA in Drosophila per definire meglio la segnalazione della ferroptosi in diversi organi e per testare farmaci che potrebbero migliorarla, per completare in seguito questi studi usando modelli di organoidi 3D da pazienti. -
Identificazione dei segnali che inducono autofagia nelle proteinopatie.
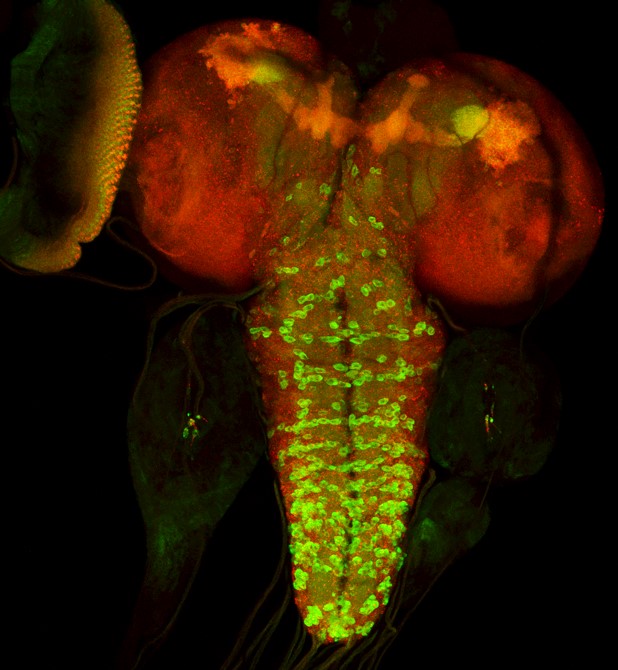
Nel cervello, il glutammato è mantenuto a livello fisiologico da un ciclo non autonomo tra glia e neuroni chiamato "ciclo glutammato-glutammina" (GGC), spesso deregolato nei pazienti con malattie da degenerazione neuronale (NDD). Per capire come il GGC controlla la sopravvivenza neuronale e quali fattori di segnalazione tra glia e neuroni portano alla sopravvivenza cellulare in NDD, moduliamo, nei neuroni o nella glia, l'espressione di enzimi chiave che controllano il GGC, utilizzando modelli di Drosophila per malattie correlate alla poliglutammina, come la malattia di Huntington (HD), le atassie spinocerebellari (SCA) e la sclerosi laterale amiotrofica (SLA). Abbiamo scoperto che la manipolazione degli enzimi che controllano il GGC attiva l'autofagia, fondamentale per la sopravvivenza neuronale. Utilizzando approcci genetici e di metabolomica, stiamo attualmente determinando i meccanismi molecolari che attivano l'autofagia in vivo, portando alla riduzione degli aggregati proteici tossici. -
Infiammazione cronica in un modello di obesità e insulino-resistenza.
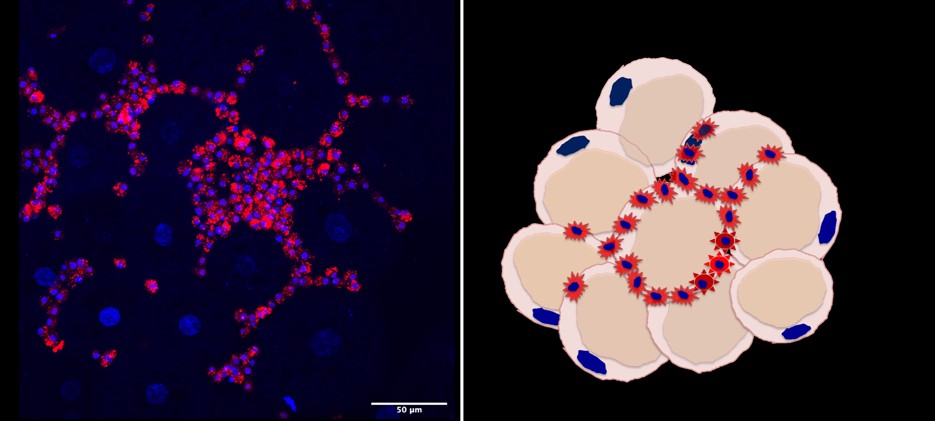 Nelle persone obese, le cellule immunitarie si infiltrano nel tessuto adiposo promuovendo un'infiammazione cronica di basso grado o macrofagi del tessuto adipocitario (ATM). Questo stato è stato collegato ad un’alterata funzione metabolica degli adipociti e all'induzione di insulino-resistenza. Usando Drosophila, dove la relazione tra le cellule immunitarie, gli emociti (simili ai macrofagi) e il tessuto adiposo larvale (FB) è conservata, abbiamo dimostrato che bio-componenti commestibili come antiossidanti e farmaci antidiabetici riducono l'infiammazione cronica e migliorano resistenza all'insulina. Tra diversi segnali, abbiamo identificato eiger/TNFa come rilevante per il reclutamento di emociti nelle cellule adipose, suggerendo che nel nostro modello sono conservate le condizioni più importanti descritte nell'obesità e nei disordini metabolici umani. Attualmente stiamo effettuando uno screening (genetico e chimico) per farmaci antidiabetici che possono recuperare la resistenza all'insulina nel nostro modello.
Nelle persone obese, le cellule immunitarie si infiltrano nel tessuto adiposo promuovendo un'infiammazione cronica di basso grado o macrofagi del tessuto adipocitario (ATM). Questo stato è stato collegato ad un’alterata funzione metabolica degli adipociti e all'induzione di insulino-resistenza. Usando Drosophila, dove la relazione tra le cellule immunitarie, gli emociti (simili ai macrofagi) e il tessuto adiposo larvale (FB) è conservata, abbiamo dimostrato che bio-componenti commestibili come antiossidanti e farmaci antidiabetici riducono l'infiammazione cronica e migliorano resistenza all'insulina. Tra diversi segnali, abbiamo identificato eiger/TNFa come rilevante per il reclutamento di emociti nelle cellule adipose, suggerendo che nel nostro modello sono conservate le condizioni più importanti descritte nell'obesità e nei disordini metabolici umani. Attualmente stiamo effettuando uno screening (genetico e chimico) per farmaci antidiabetici che possono recuperare la resistenza all'insulina nel nostro modello.
Posizioni disponibili
Quest'anno è disponibile una posizione di studente di dottorato sul progetto 1; si prega di contattare il PI.
Gli studenti LM e LT sono invitati a candidarsi per il loro tirocinio.
Membri del gruppo
- Paola Bellosta, PI*
- Valeria Manara, dottoranda
- Andrea Vutera Cuda, studentessa MA
- Anna Valerio, post-laurea
- Melissa Perdezolli, studentessa
- Edoardo Barion, studente
* presente
Professore associato aggiunto, Dipartimento di Medicina NYU Langone Medical Center, New York, USA
Membro della COST-21154 Translational Control in Cancer European Network
Member of the Drosophila European Network http//droseu.net
2018-22 Membro del comitato scientifico consultivo della Rete europea per la malattia di Huntington
2009-17 Membro del Centro di diabetologia ed endocrinologia (DERC) Columbia University, New York, NY, USA
Collaborazioni
- Franco Taroni, Cinzia Gellera, Istituto Neurologico "C. Besta" Milano, Italia
- Alessandro Provenzani, Ágata S. Carreira, CIBIO, Università degli studi di Trento, Italia
- Gabriella Viero, Fondazione Bruno Kessler, Trento, Italia
- Maria A. Vanoni, Università di Milano, Italia
- Tom Vanden Berghe, Greta Klejborowska, Università di Anversa, Belgio
- Laura Johnston, Columbia University, NY
- Hugo Stocker, ETH, Zurigo, CH
- Florenci Serras, Università di Barcellona, Spagna
- Adam Bajar, University of South Boemia, Ceske Budejovice, Repubblica Ceca
Pubblicazioni selezionate
Manara V, Radoani M, Belli R, Peroni D, Destefanis F, Angheben L, Tome G, Tebaldi T, Bellosta P. NOC1 is a direct MYC target, and its protein interactome dissects its activity in controlling nucleolar function. Front Cell Dev Biol. 2023 Dec 28;11:1293420. doi: 10.3389/fcell.2023.1293420.
Mirzoyan Z, Valenza A, Zola S, Bonfanti C, Arnaboldi L, Ferrari N, Pollard J, Lupi V, Cassinelli M, Frattaroli M, Sahin M, Pasini ME, Bellosta P. A Drosophila model targets Eiger/TNFα to alleviate obesity-related insulin resistance and macrophage infiltration. Dis Model Mech. 2023 Nov 1;16(11):dmm050388. doi: 10.1242/dmm.050388.
Santarelli S, Londero C, Soldano A, Candelaresi C, Todeschini L, Vernizzi L, Bellosta P. Front Neurosci. Drosophila melanogaster as a model to study autophagy in neurodegenerative diseases induced by proteinopathies. 2023 May 18;17:1082047. doi: 10.3389/fnins
Vitali T, Vanoni MA, Bellosta P. Quantitation of Glutamine Synthetase 1 Activity in Drosophila melanogaster. Methods Mol Biol. 2023 2675:237-260. doi: 10.1007/978-1-0716-3247-5-18.
Destefanis F, Manara V, Santarelli S, Zola S, Brambilla M, Viola G, Maragno P, I. Signoria, Viero G, Pasini ME, Penzo M and Bellosta P. Reduction of nucleolar NOC1 leads to the accumulation of pre-rRNAs and induces Xrp1, affecting growth and resulting in cell competition.
J Cell Sci. 2022 Dec 1;135(23) jcs260110. doi: 10.1242/jcs.260110. Cover
Destefanis F, Manara V, Bellosta P. Myc as a Regulator of Ribosome Biogenesis and Cell Competition: A Link to Cancer. Int J Mol Sci. 2020 Jun 5;21(11).
Vernizzi L, Paiardi C, Licata G, Vitali T, Santarelli S, Raneli M, Manelli V, Rizzetto M, Gioria M, Pasini ME, Grifoni D, Vanoni MA, Gellera C, Taroni F, Bellosta P. Glutamine Synthetase 1 Increases Autophagy Lysosomal Degradation of Mutant Huntingtin Aggregates in Neurons, Ameliorating Motility in a Drosophila Model for Huntington's Disease. Cells. 2020 Jan 13;9(1):196.
Bellosta P*, Soldano A*. Drosophila melanogaster, Dissecting the Genetics of Autism Spectrum Disorders: A Drosophila Perspective. Frontiers in Physiology 2019 Aug 7;1 *corr author.
Mirzoyan Z, Allocca MT, Valenza MA, Sollazzo M, Grifoni D, and Bellosta P. Drosophila melanogaster as a model organism to study cancer growth. Frontiers in Genetics. 2019 Mar 1;10:51.
Valenza A, Bonfanti C, Pasini MA, Bellosta P. Anti-inflammatory effect of anthocyanins in a Drosophila model of chronic inflammation., Biomed Res Int. 2018 Mar 12;2018.
Di Giacomo S, Sollazzo M, de Biase D, Ragazzi M, Bellosta P, Pession A, Grifoni D. Human Cancer Cells Signal Their Competitive Fitness Through MYC Activity. Sci Rep. 2017 Oct 3;7(1):12568.
Allocca MT, Zola S, Bellosta P. Modeling of Human Diseases using The Fruit Fly, Drosophila Melanogaster. Drosophila melanogaster - Model for Recent Advances in Genetics and Therapeutics InTech Open 2017 ISBN 978-953-51-5484-6.
Paiardi C, Mirzoyan Z, Zola S, Parisi F, Vingiani A, Pasini ME, Bellosta P. Genes (Basel). The Stearoyl-CoA Desaturase-1 (Desat1) in Drosophila cooperates with Myc to Induce Autophagy and Growth, a Potential New Link to Tumor Survival. 2017 Apr 28;8(5).
De la Cova C, Senoo-Matsuda N, Ziosi M, Wu C, Bellosta P. Quinzii CM and Johnston L. Super-competitor status of Drosophila Myc cells requires p53 as a fitness sensor to reprogram metabolism and promote viability. Cell Metabolism 2014 19(3):470-83.
Parisi F, Riccardo S, Zola S, Lora C, Grifoni D, Brown L and Bellosta P. dMyc expression in the fat body affects DILP2 release and increases the expression of the fat desaturase Desat1 resulting in organismal growth. Dev Biol. 2013 379(1):64-75 F1000Prime.
Drosophila insulin and target of rapamycin (TOR) pathways regulate GSK3 beta activity to control Myc stability and determine Myc expression in vivo. BMC Biol. 2011 Sep 27;9:65.
Parisi F, Riccardo S, Daniel M, Saqcena M, Kundu N, Pession A, Grifoni D, Stocker H, Tabak E, Bellosta P. dMyc functions downstream of Yorkie to promote the supercompetitive behavior of hippo pathway mutant cells. Ziosi M, Baena-López LA, Grifoni D, Froldi F, Pession A, Garoia F, Trotta V, Bellosta P, Cavicchi S, Pession A. PLoS Genet. 2010 Sep 23;6(9).
Galletti M, Riccardo S, Parisi F, Lora C, Saqcena MK, Rivas L, Wong B, Serra A, Serras F, Grifoni D, Pelicci P, Jiang J, Bellosta P. Identification of domains responsible for ubiquitin-dependent degradation of dMyc by glycogen synthase kinase 3beta and casein kinase 1 kinases. Mol Cell Biol. 2009 Jun;29(12):3424-34. Cover
Bellosta P, Hulf T, Balla Diop S, Usseglio F, Pradel J, Aragnol D, Gallant P. Myc interacts genetically with Tip48/Reptin and Tip49/Pontin to control growth and proliferation during Drosophila development. Proc Natl Acad Sci U S A. 2005 Aug 16;102(33):11799-804.
De la Cova C, Abril M, Bellosta P, Gallant P, Johnston LA. Drosophila myc regulates organ size by inducing cell competition. Cell. 2004 Apr 2;117(1):107-16. Cover
La lista completa è disponibile al seguente link: https://pubmed.ncbi.nlm.nih.gov/?term=bellosta+p&sort=date
