Panoramica
Il muscolo scheletrico è il tessuto più abbondante nel corpo dei vertebrati. Diverse centinaia di muscoli sono presenti nel corpo umano. Svolgono un ruolo importante non solo nel controllo dei movimenti e della postura, ma sono anche necessari per la respirazione, per il controllo della temperatura corporea ed esercitano un'importante funzione metabolica. Sebbene i muscoli appaiano superficialmente simili in diverse posizioni anatomiche, in realtà presentano caratteristiche diverse. L'eterogeneità è evidente durante lo sviluppo a livello molecolare e cellulare. Diverse classi di precursori muscolari con caratteristiche diverse compaiono prima della nascita e, differenziandosi in fibre sinciziali, contribuiscono alla diversificazione muscolare.
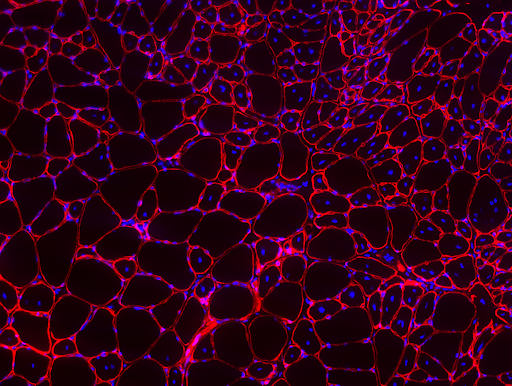 È importante sottolineare che non tutti i progenitori miogenici si differenziano in fibre durante lo sviluppo, ma una frazione di essi rimane nei muscoli adulti come pool indifferenziato di cellule staminali. Queste cellule staminali mediano la riparazione muscolare. In condizioni normali i muscoli scheletrici presentano una risposta rigenerativa molto potente quando vengono sollecitati da un danno. Tuttavia, il potenziale rigenerativo viene progressivamente perso in condizioni fisiopatologiche specifiche, come l'invecchiamento o diverse malattie neuromuscolari, in cui il tessuto fibrotico sostituisce progressivamente le fibre muscolari portando a una compromissione della funzionalità muscolare. Utilizzando una combinazione di approcci innovativi in vitro e in vivo, stiamo esplorando gli eventi cellulari e molecolari responsabili della rigenerazione difettosa e dell'accumulo di tessuto fibrotico nel muscolo patologico al fine di porre le basi per terapie efficaci e specifiche. Utilizzando il sistema muscolare scheletrico, un tessuto caratterizzato da una presenza particolarmente ricca di cellule staminali, stiamo studiando il ruolo di cruciali vie di trasduzione del segnale, come le vie del TGFβ, Notch e WNT, nella regolazione del comportamento delle cellule staminali. Questa ricerca contribuirà in ultima analisi alla nostra comprensione dei meccanismi molecolari generali che controllano la gerarchia e funzione delle cellule staminali e aumenterà la nostra comprensione delle patologie caratterizzate dalla loro alterazione. Curiosamente, la comprensione degli eventi che portano alla differenziazione muscolare aprirà la strada alla generazione di tessuto funzionale in vitro, che finirà per essere utile non solo per la sostituzione dei muscoli danneggiati ma anche per la produzione di carne a base cellulare. Nel nostro laboratorio sono attualmente in corso studi volti all'ottimizzazione dei protocolli di produzione di carne a base cellulare.
È importante sottolineare che non tutti i progenitori miogenici si differenziano in fibre durante lo sviluppo, ma una frazione di essi rimane nei muscoli adulti come pool indifferenziato di cellule staminali. Queste cellule staminali mediano la riparazione muscolare. In condizioni normali i muscoli scheletrici presentano una risposta rigenerativa molto potente quando vengono sollecitati da un danno. Tuttavia, il potenziale rigenerativo viene progressivamente perso in condizioni fisiopatologiche specifiche, come l'invecchiamento o diverse malattie neuromuscolari, in cui il tessuto fibrotico sostituisce progressivamente le fibre muscolari portando a una compromissione della funzionalità muscolare. Utilizzando una combinazione di approcci innovativi in vitro e in vivo, stiamo esplorando gli eventi cellulari e molecolari responsabili della rigenerazione difettosa e dell'accumulo di tessuto fibrotico nel muscolo patologico al fine di porre le basi per terapie efficaci e specifiche. Utilizzando il sistema muscolare scheletrico, un tessuto caratterizzato da una presenza particolarmente ricca di cellule staminali, stiamo studiando il ruolo di cruciali vie di trasduzione del segnale, come le vie del TGFβ, Notch e WNT, nella regolazione del comportamento delle cellule staminali. Questa ricerca contribuirà in ultima analisi alla nostra comprensione dei meccanismi molecolari generali che controllano la gerarchia e funzione delle cellule staminali e aumenterà la nostra comprensione delle patologie caratterizzate dalla loro alterazione. Curiosamente, la comprensione degli eventi che portano alla differenziazione muscolare aprirà la strada alla generazione di tessuto funzionale in vitro, che finirà per essere utile non solo per la sostituzione dei muscoli danneggiati ma anche per la produzione di carne a base cellulare. Nel nostro laboratorio sono attualmente in corso studi volti all'ottimizzazione dei protocolli di produzione di carne a base cellulare.
Linee di ricerca
- Disfunzione delle cellule staminali nelle malattie neuromuscolari e nell'invecchiamento
- Eterogeneità delle cellule staminali
- Meccanismi della fibrosi
- Terapia cellulare e genica delle patologie muscolari e dello sviluppo
- Modellazione in vitro delle malattie muscolari
- Specificazione e differenziazione miogenica
- Generazione di linee cellulari miogeniche adatte alla produzione di carne a base cellulare
Membri del gruppo
- Stefano Biressi, PI
- Michela Libergoli, Post-doc
- Francesca Florio, Post-doc
- Giulia Fioravanti, Studentessa PhD
- Nike Schiavo, Ricercatore borsista
Collaborazioni
- Luciano Conti, Dipartimento di Biologia Cellulare, Computazionale e Integrata - CIBIO, Università di Trento, Italia
- Giovanni Piccoli, Dipartimento di Biologia Cellulare, Computazionale e Integrata - CIBIO, Università di Trento, Italia
- Jessika Bertacchini, Università di Modena, Italia
- Yvan Torrente, Università degli Studi di Milano, Italia
- Lorenzo Giordani, Sorbonne Université, Parigi, Francia
- Thomas Rando, Stanford University, California
- Maria Pennuto, Università di Padova, Italia
- Paolo Bonaldo, Università di Padova, Italia
- Mattia Pelizzola, Istituto Italiano di Tecnologia (iit), Milano, Italia
- Jean Farup, Aarhus University, Danimarca
- Benoit Viollet, Institute Cochin, Parigi, Francia
- Cesare Gargioli, Università Roma Tor Vergata, Italia
- Diana Massai, Politecnico di Torino, Italia
Pubblicazioni selezionate
Cossu G., Tonlorenzi R., Brunelli S., Sampaolesi M., Messina G., Azzoni E., Benedetti S., Biressi S. et al. “Mesoangioblasts at 20: From the embryonic aorta to the patient bed”. Front Genet. 2023: 13:1056114.
Florio F., Accordini S., Libergoli M., Biressi S. “Targeting muscle-resident single cells through in vivo electro-enhanced plasmid transfer in healthy and compromised skeletal muscle”. Front Physiology. 2022: 13:834705.
Magarò MS, Bertacchini J, Florio F, Zavatti M, Potì F, Cavani F, Amore E, De Santis I, Bevilacqua A, Reggiani Bonetti L, Torricelli P, Maurel DB, Biressi S., Palumbo C. “Identification of Sclerostin as a Putative New Myokine Involved in the Muscle-to-Bone Crosstalk”. Biomedicines. 2021: 9(1):E71.
Bauer J., Cuvelier N, Ragab N, Simon-Keller K., Nitzki F., Geyer N., Botermann D.S., Elmer D.P., Rosenberger A., Rando T.A., Biressi S. et al. “Context-dependent modulation of aggressiveness of pediatric tumors by individual oncogenic RAS isoforms.” Oncogene. 2021:40(31):4955-4966.
Biressi S., Filareto A, Rando TA. "Stem cell therapy for muscular dystrophies". J Clin Invest. 2020;130(11):5652-5664.
Kheir E, Cusella G, Messina G, Cossu G, & Biressi S. “Reporter-based Isolation of Developmental Myogenic Progenitors.” Front Physiol. 2018; 5;9:352.
de Morrée A, van Velthoven C, Gan Q, Salvi JS, Klein JD, Akimenko I, Quarta M, Biressi S., and Rando TA. “Staufen1 inhibits MyoD translation to actively maintain muscle stem cell quiescence”. PNAS. 2017; 114(43), E8996-9005.
Biressi S., and Gopinath, SD. The quasi-parallel lives of satellite cells and atrophying muscle. Front. Aging Neurosci. 2015; 7, 140.
Biressi S., Miyabara EH, Gopinath SD, Carlig PMM, Rando TA. “A Wnt-TGFβ2 axis induces a fibrogenic program in muscle stem cells from dystrophic mice”. Sci Transl Med. 2014; 267, 176.
George RM*, Biressi S.*, Beres B, Rogers R, Geiger L, Mulia A, Allen ER, Rawls A, Rando TA and Wilson-Rawls J. “Numb deficient satellite cells have a regeneration and proliferation defect”. *These authors equally contributed to this work. PNAS. 2013; 110(46), 18549-54.
Messina G*, Biressi S.*, Monteverde S, Magli A, Cassano M, Perani L, Roncaglia E, Tagliafico E, Starnes L, Cambpell CE, Grossi M, Goldhamer DJ, Gronostajski RM, Cossu G. “Nfix regulates fetal specific transcription in developing skeletal muscle”. *These authors equally contributed to this work. Cell. 2010; 140 (4), 554-66.
Biressi S., Rando TA. “Heterogeneity in the muscle satellite cell population”. Semin Cell Dev Biol. 2010; 21(8), 845-54.
Per una lista completa: http://www.ncbi.nlm.nih.gov/pubmed/?term=Biressi+S.
