Panoramica
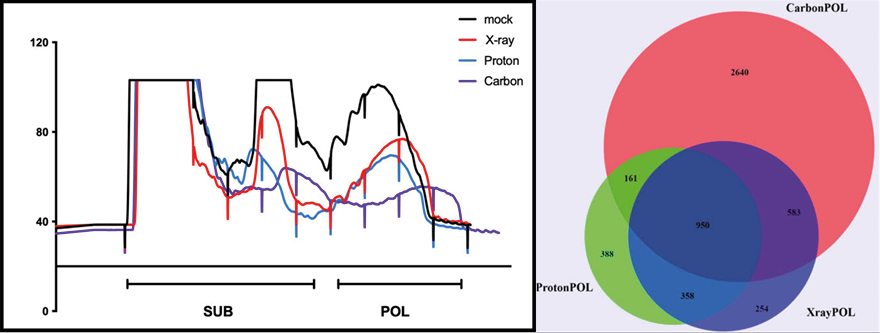
La radioterapia è uno strumento importante per il trattamento del cancro; infatti, circa il 50% di tutti i pazienti affetti da tumore maligno ricevono questo tipo di terapia durante il corso della malattia.
L'obiettivo della radioterapia è quello di distruggere le cellule tumorali in modo efficiente attraverso l’utilizzo di radiazioni ionizzanti che sono in grado di causare gravi danni al DNA con conseguente morte delle cellule tumorali, riducendo al minimo l'esposizione dei tessuti circostanti sani e degli organi a rischio.
Questo traguardo è stato facilitato dal recente sviluppo di sofisticate tecniche di irradiazione, tra cui la terapia che utilizza Particelle Cariche (Charged Particle Therapy - CPT) e la radioterapia ad intensità modulata. Fino ad oggi, la Protonterapia (o terapia protonica) è la metodologia più utilizzata tra quelle che utilizzano particelle cariche positivamente. Anche se in termini di effetti biologici è simile ai raggi X, il fascio di protoni può depositare la sua energia più precisamente, riducendo così l'esposizione dei tessuti normali.
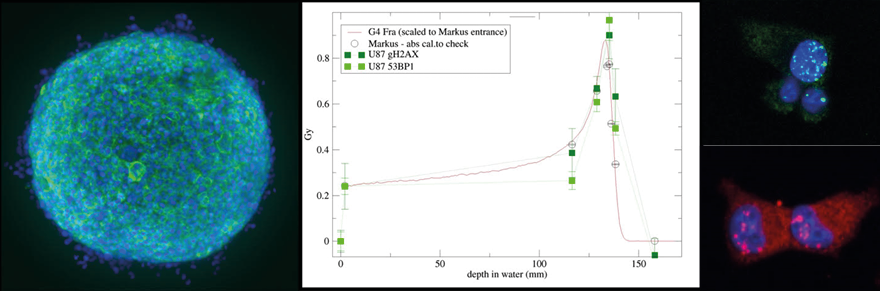
L'obiettivo principale del laboratorio è la caratterizzazione dei diversi meccanismi biologici attivati dalla radioterapia, in particolare la protonterapia, nelle cellule tumorali e normali utilizzando diversi modelli come colture cellulari 2D, sferoidi 3D e scaffold che mimano la matrice extracellulare per comprendere meglio le risposte del tumore e dei tessuti sani alla radioterapia.
Indirizzi di ricerca
- p21 come attore principale della radioresistenza delle cellule tumorali.
- Svelare i meccanismi molecolari alla base dell'effetto abscopico.
- Sviluppo e caratterizzazione di modelli 3D innovativi in vitro.
- Caratterizzazione biologica della radioterapia FLASH con fascio di particelle ad alto rateo di dose.
Membri del gruppo
- Alessandra Bisio, PI
- Laura Bartolomei, dottoranda
- Samuele Bugnara, studentessa di Master
Collaborazioni
- Emanuele Scifoni, TIFPA - Trento Institute for Fundamental Physics and Applications, Trento, Italia
- Juergen Borlak, Hannover Medical School (MHH), Germania
- Alberto Inga, Dipartimento di Biologia Cellulare, Computazionale e Integrata - CIBIO, Università degli studi di Trento, Italia
- Walter Tinganelli, GSI Helmholtz Centre for Heavy Ion Research, Darmstadt, Germania
- Devid Maniglio, Dipartimento di Ingegneria industriale, Università degli studi di Trento, Italia
- Takashi Shimohkawa, NIRS- National Institute of Radiological Sciences, Chiba, Giappone
- Antonella Motta, Dipartimento di Ingegneria industriale, Università degli studi di Trento, Italia
- Ira-Ida Skvortsova Medical University of Innsbruck Tyrolean Cancer Research Institute, Innsbruck, Austria
- Palmina Simoniello, Università degli Studi di Napoli Parthenope, Napoli, Italia
- Francesco Cammarata, Giorgio Russo, CNR-IBFM, Cefalù, Italia
Pubblicazioni selezionate
- Bosco B, Rossi A, Rizzotto D, Hamadou M, Bisio A, Giorgetta S, Perzolli A, Bonollo F, Gaucherot A, Catez F, Diaz JJ, Dessi E, Inga A. DHX30Coordinates Cytoplasmic Translation and Mitochondrial Function Contributing to Cancer Cell Sur-vival. Cancers, MDPI, 2021, 13, 10.3390/cancers13174412
- Galeaz C, Totis C, Bisio A. Radiation Resistance: A Matter of Transcription Factors. Front Oncol. 2021 Jun 1;11:662840. doi: 10.3389/fonc.2021.662840. eCollection 2021.
- Alaimo A, Lorenzoni M, Ambrosino P, Bertossi A, Bisio A, Macchia A, Zoni E, Genovesi S, Cambuli F, Foletto V, De Felice D, Soldovieri MV, Mosca I, Gandolfi F, Brunelli M, Petris G, Cereseto A, Villarroel A, Thalmann G, Carbone FG, Kruithof-de Julio M, Barbareschi M, Romanel A, Taglialatela M, Lunardi A. Calcium cytotoxicity sensitizes prostate cancer cells to standard-of-care treatments for locally advanced tumors. Cell Death Dis. 2020 Dec 7;11(12):1039. doi: 10.1038/s41419-020-03256-5.
- Ballan M, Tosato M, Verona M, Caeran M, Borgna F, Vettorato E, Corradetti S, Zangrando L, Sgaravatto M, Verlato M, Asti M, Marzaro G, Mastrotto F, Di Marco V, Maniglio D, Bisio A, Motta A, Quaranta A, Zenoni A, Pastore P, Realdon N, Andrighetto A. Preliminary evaluation of the production of non-carrier added 111Ag as core of a therapeutic radiopharmaceutical in the framework of ISOLPHARM_Ag experiment. Appl Radiat Isot. 2020 Oct; 164:109258. doi: 10.1016/j.apradiso.2020.109258.
- Ebner DK, Tinganelli W, Helm A, Bisio A, Simoniello P, Natale F, et al. Generating and grading the abscopal effect: Proposal for comprehensive evaluation of combination immunoradiotherapy in mouse models. Translational Cancer Research. 2017;6:S892-S9. doi: 10.21037/tcr.2017.06.01
- Ebner DK, Tinganelli W, Helm A, Bisio A, Yamada S, Kamada T, et al. The immunoregulatory potential of particle radiation in cancer therapy. Frontiers in Immunology. 2017; Feb 6;8:99. doi: 10.3389/fimmu.2017.00099. eCollection 2017.
- Andreotti V*, Bisio A*, Bressac-de Paillerets B, Harland M, Cabaret O, Newton-Bishop J, et al. The CDKN2A/p16INK4a5'UTR sequence and translational regulation: Impact of novel variants predisposing to melanoma. Pigment Cell and Melanoma Research. 2016;29(2):210-21. doi: 10.1111/pcmr.12444
- Sharma V, Jordan JJ, Ciribilli Y, Resnick MA, Bisio A§, Inga A§. Quantitative analysis of NF-κB transactivation specificity using a yeast-based functional assay. PLoS ONE. 2015;10(7). doi: 10.1371/journal.pone.0130170
- Bisio A, Latorre E, Andreotti V, Paillerets BB, Harland M, Scarra GB, et al. The 5'-untranslated region of p 16INK4amelanoma tumor suppressor acts as a cellular IRES, controlling mRNA translation under hypoxia through YBX1 binding. Oncotarget. 2015;6(37):39980-94. doi: 10.18632/oncotarget.5387
- Zaccara S, Tebaldi T, Pederiva C, Ciribilli Y, Bisio A, Inga A. P53-directed translational control can shape and expand the universe of p53 target genes. Cell Death and Differentiation. 2014;21(10):1522-34. doi: 10.1038/cdd.2014.79
- Bisio A, Zámborszky J, Zaccara S, Lion M, Tebaldi T, Sharma V, et al. Cooperative interactions between p53 and NFκB enhance cell plasticity. Oncotarget. 2014;5(23):12111-25. doi: 10.18632/oncotarget.2545
- Bisio A, De Sanctis V, Del Vescovo V, Denti MA, Jegga AG, Inga A, et al. Identification of new p53 target microRNAs by bioinformatics and functional analysis. BMC cancer. 2013;13. doi: 10.1186/1471-2407-13-552
- Bisio A, Nasti S, Jordan JJ, Gargiulo S, Pastorino L, Provenzani A, et al. Functional analysis of CDKN2A/p16INK4a5′-UTR variants predisposing to melanoma. Human Molecular Genetics. 2010;19(8):1479-91. doi: 10.1093/hmg/ddq022
