Panoramica
La vista è uno dei sensi più cruciali per l'uomo e dipende dalla funzionalità della retina. Mutazioni in geni retinici non sono letali e possono causare forme specifiche e invalidanti di degenerazioni retiniche dovute alla morte dei fotorecettori, come la Retinite pigmentosa. Le distrofie retiniche ereditarie rappresentano la principale causa di cecità nel mondo, per la maggior parte di queste non abbiamo ancora una cura. Anche se molti dei geni coinvolti in queste malattie sono stati identificati, i meccanismi molecolari alla base della morte dei fotorecettori devono ancora essere completamente chiariti. Abbiamo quindi bisogno di sviluppare modelli efficaci in grado di ricapitolare i meccanismi molecolari della malattia e che possano essere utilizzati per sviluppare nuovi approcci terapeutici.
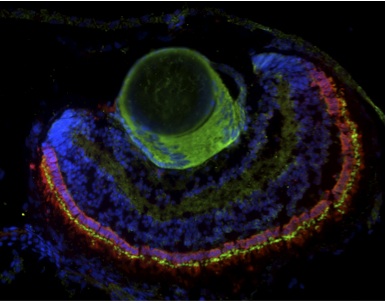
Linee di ricerca
Il nostro laboratorio studia i fattori che guidano il differenziamento e la sopravvivenza dei neuroni retinici. Il nostro obiettivo è identificare i meccanismi che mantengono la funzionalità retinica e come questi possono essere alterati in condizioni patologiche. Per questo utilizziamo un approccio multidisciplinare, dalle colture cellulari tridimensionali ai modelli genetici.
Gli sforzi attuali si concentrano sulla caratterizzazione di un nuovo modello di zebrafish di Retinite pigmentosa, causata da mutazioni in IMPG2, un proteoglicano specifico dei fotorecettori. Utilizzeremo inoltre questo modello per la ricerca di nuovi farmaci.
Membri del gruppo
- Simona Casarosa, PI
- Maria Elena Castellini, dottoranda
Collaborazioni
- Emiliano Biasini, CIBIO Dep.t, Università di Trento, Italia
- Michela Denti, CIBIO Dep.t, Università di Trento, Italia
- Yuri Bozzi, CIMeC, Università di Trento, Italia
- Maria Claudia Gargini, Università di Pisa, Italia
Pubblicazioni selezionate
Gilmozzi V, Gentile G, Riekschnitz DA, Von Troyer M, Lavdas AA, Kerschbamer E, Weichenberger CX, Rosato-Siri MD, Casarosa S., Conti L, Pramstaller PP, Hicks AA, Pichler I, Zanon A. (2021). Generation of hiPSC-Derived Functional Dopaminergic Neurons in Alginate-Based 3D Culture. Front Cell Dev Biol. 9:708389. doi: 10.3389/fcell.2021.708389. eCollection 2021.
Karali M., Guadagnino I., Marrocco E., De Cegli R., Carissimo A., Pizzo M., Casarosa S., Conte I., Surace E.M., Banfi S. (2019). AAV-miR-204 protects from retinal degeneration by attenuation of microglia activation and photoreceptor cell death. Molecular Therapy 19:144-156. doi: 10.1016/j.omtn.2019.11.005. Epub 2019 Nov 18.
Zhang X, Piano I, Messina A, D'Antongiovanni V, Crò F, Provenzano G, Bozzi Y, Gargini C, Casarosa S. (2019). Retinal Defects in Mice Lacking the Autism-Associated Gene Engrailed-2. Neuroscience. Apr 10. pii: S0306-4522 (19) 30236-2. doi: 10.1016/j.neuroscience.2019.03.061. [Epub ahead of print]
Chelini G, Zerbi V, Cimino L, Grigoli A, Markicevic M, Libera F, Robbiati S, Gadler M, Bronzoni S, Miorelli S, Galbusera A, Gozzi A, Casarosa S., Provenzano G, Bozzi Y. (2019). Aberrant somatosensory processing and connectivity in mice lacking Engrailed-2. J Neurosci. 39:1525-1538. doi: 10.1523/JNEUROSCI.0612-18.2018
Poggi L., Casarosa S., Carl M. (2018). An eye on the Wnt inhibitory factor Wif1. Front. Cell Dev. Biol. doi.org/10.3389/fcell.2018.00167.
Bertacchi M., Lupo G., Pandolfini L., Casarosa S., D’Onofrio M., Pedersen R.A., Harris W.A. and Cremisi F. (2015). Activin/Nodal Signaling Supports Retinal Progenitor Specification in a Narrow Time Window during Pluripotent Stem Cell Neuralization. Stem Cell Reports http://dx.doi.org/10.1016/j.stemcr.2015.08.011
Caputo A., Piano I., Demontis G.C., Bacchi N., Casarosa S., Della Santina L., Gargini C. (2015). TMEM16A is associated with voltage-gated calcium channels in mouse retina and its function is disrupted upon mutation of the auxiliary α2δ4 subunit. Front Cell Neurosci. 9:422. doi: 10.3389/fncel.2015.00422.
Bacchi N, Messina A, Burtscher V, Dassi E, Provenzano G, Bozzi Y, Demontis GC, Koschak A, Denti MA, Casarosa S. (2015). A New Splicing Isoform of Cacna2d4 Mimicking the Effects of c.2451insC Mutation in the Retina: Novel Molecular and Electrophysiological Insights. Invest Ophthalmol Vis Sci. 2015 Jul 1;56(8):4846-56. doi: 10.1167/iovs.15-16410.
Sun W., Incitti T., Migliaresi C., Quattrone A., Casarosa S., Motta A. (2015). Viability and neuronal differentiation of neural stem cells encapsulated in silk fibroin hydrogel functionalized with an IKVAV peptide. J Tissue Eng Regen Med. doi: 10.1002/term.2053.
Messina A., Lan L., Incitti T., Bozza A., Andreazzoli M., Vignali R., Cremisi F., Bozzi Y., Casarosa S. (2015). Noggin-Mediated Retinal Induction Reveals a Novel Interplay Between Bone Morphogenetic Protein Inhibition, Transforming Growth Factor β, and Sonic Hedgehog Signaling. Stem Cells 33(8):2496-508. doi: 10.1002/stem.2043.
