Panoramica
Le metastasi sono la principale causa di morte nei pazienti oncologici. La formazione di metastasi è influenzata da diversi tipi di interazioni tumore-stroma, in cui le componenti stromali del microambiente tumorale possono influenzare il comportamento delle cellule tumorali. I tumori al seno ormone-dipendenti diventano frequentemente refrattari alla terapia ormonale (inizialmente efficace), e, di conseguenza, spesso vengono trattati con la chemioterapia. La chemioterapia, infatti, rappresenta ancora l’opzione più comune per il cancro al seno in stadio avanzato. Tuttavia, è stato dimostrato che la chemioterapia stessa, nonostante determini la riduzione del tumore primario, possa favorire il processo metastatico attraverso l’induzione della Transizione Epitelio-Mesenchimale (EMT). Inoltre, le cellule tumorali possono sviluppare resistenza ai farmaci chemioterapici, risultando nell’insuccesso del trattamento e nella formazione di recidive.
L’interesse principale del nostro Gruppo di ricerca è focalizzato nell’esplorazione dei meccanismi che stanno alla base della chemioresistenza e del processo metastatico, specialmente nel cancro al seno. Una particolare attenzione viene data alla riprogrammazione dei network di espressione genica dipendenti dall’azione di fattori di trascrizione con un ruolo prominente nella biologia dei tumori, come p53, ETV7 e NF-κB.
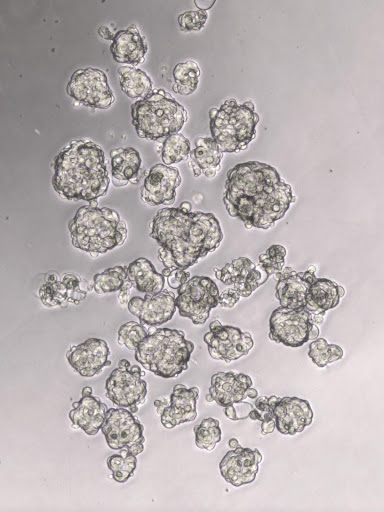
Inoltre, le attività del laboratorio sono anche focalizzate sullo studio delle Cellule Staminali Tumorali (CSCs). Le CSCs rappresentano una popolazione cellulare parte integrante della massa tumorale con proprietà di self-renewal che sono associate all’aggressività delle cellule cancerose. Queste cellule sono considerate essere intrinsecamente estremamente chemioresistenti, e le CSCs sembrano giocare un ruolo primario nelle recidive che si verificano dopo la chemioterapia. Tuttavia, nonostante siano studiate da molti anni, i meccanismi che stanno alla base delle CSCs non sono ancora completamente noti, e bersagliarle farmacologicamente in maniera specifica risulta ancora complicato. Inoltre, persino la quiescenza tumorale è stata associata alle CSCs. Di conseguenza, l’identificazione dei pathways e dei meccanismi coinvolti nell’aumento della sottopopolazione di CSCs o della resistenza ai farmaci o degli effetti indesiderati associati alla chemioterapia è un obiettivo urgente ed essenziale per la ricerca sul cancro orientata al miglioramento dell’efficacia dei trattamenti.
Le attività del Laboratorio di Molecular Cancer Genetics sono primariamente focalizzate allo sviluppo di saggi trascrizionali, genome-wide e 3D usando come modelli sperimentali linee cellulari derivate da tumore e cellule primarie. Vengono inoltre effettuate analisi molecolari su biopsie derivate da pazienti oncologici.
Indirizzi di ricerca
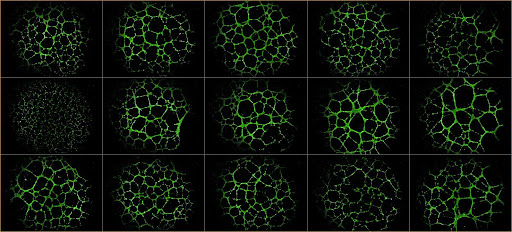
Le principali direzioni di ricerca sono focalizzate sull'analisi dell’espressione genica in linee cellulari e pazienti con tumori al seno ed al colon, studi in vitro in 2D e 3D e modelli di metastasi e angiogenesi.
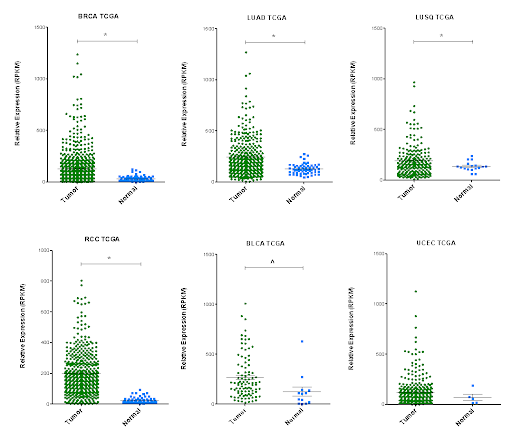
- Identificazione dei meccanismi molecolari che stanno alla base dell’aumentata chemioresistenza e staminalità mediate dal network trascrizionale governato dal repressore ETV7.
- Determinazione dell’espressione, localizzazione subcellulare e funzioni delle isoforme di p53 nelle cellule tumorali.
- Definizione del valore prognostico di “gene signatures” identificate recentemente in pazienti affetti da cancro al seno o al colon.
- Ruolo dell’EMT come meccanismo di resistenza alla chemioterapia.
- Definizione del ruolo del microambiente nell’angiogenesi tumorale e nella formazione di metastasi.
Membri del gruppo
- Yari Ciribilli, PI
- Erna Marjia Meškytė, PhD student
- Yassine Khalij, PhD student
- Sabiha Keskas, visting PhD student
Candidati motivati, inclusi studenti di master o laureati o dottorandi, interessati negli argomenti di ricerca, sono incoraggiati a contattare il PI (yari.ciribilli [at] unitn.it).
Collaborazioni
- Juergen Borlak, Scuola di medicina di Hannover (MHH), Germania
- Daniel Menendez, National Institute for Environmental Health Sciences (NIEHS, NIH), Research Triangle Park, NC, USA
- Jean-Christophe Bourdon, Dundee Cancer Centre, Università di Dundee, Scozia
- Ira-Ida Skvortsova (Università di Medicina di Innsbruck, Austria)
- Eva Martinez-Balibrea (Istituto catalano di oncologia, Badalona, Spagna)
- Neda Slade (Istituto Ruder Boskovic, Zagreb, Croazia)
- Stefano Indraccolo (Istituto Oncologico Veneto, Padova, Italia)
- Mattia Barbareschi, Ospedale Santa Chiara, Trento, Italia
- Antonella Ferro, Ospedale Santa Chiara, Trento, Italia
- Gilberto Fronza, Istituto Nazionale per la ricerca sul cancro (IST), Genova, Italia
Pubblicazioni selezionate
Tadijan A, Precazzini F, Hanžić N, Radić M, Gavioli N, Vlašić I, Ozretić P, Pinto L, Škreblin L, Barban G, Slade N, Ciribilli Y. Cancers (Basel). 2021 Oct 18;13(20):5231. doi: 10.3390/cancers13205231. PMID: 34680379
Pezzè L, Forcato M., Pontalti S., Badowska K.A., Rizzotto D., Skvortsova I., Bicciato S., Ciribilli Y. ETV7 regulates breast cancer stem-like cell plasticity by repressing IFN-response genes. Cell Death and Disease (2021) 12:742. Altered Expression of Shorter p53 Family Isoforms Can Impact Melanoma Aggressiveness.
Meškytė EM, Keskas S, Ciribilli Y. MYC as a Multifaceted Regulator of Tumor Microenvironment Leading to Metastasis. Int J Mol Sci. 2020 Oct 18;21(20):7710. doi: 10.3390/ijms21207710.
Ozretić P, Hanžić N, Proust B, Sabol M, Trnski D, Radić M, Musani V, Ciribilli Y, Milas I, Puljiz Z, Bosnar MH, Levanat S, Slade N. Expression profiles of p53/p73, NME and GLI families in metastatic melanoma tissue and cell lines. Sci Rep. 2019 Aug 28;9(1):12470.
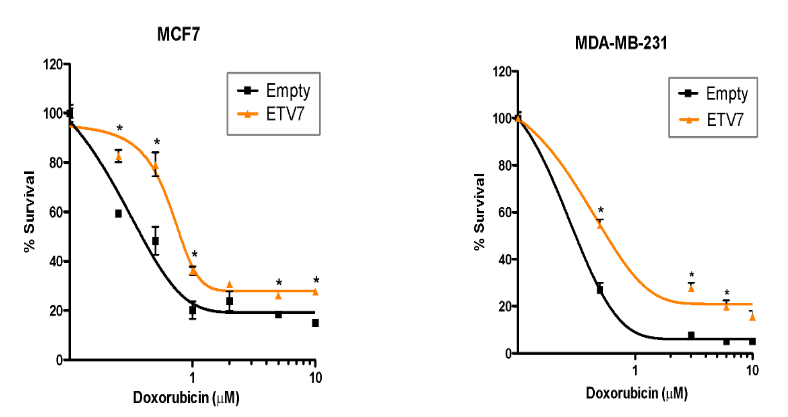
Alessandrini F*, Pezzè L*, Menendez D, Resnick MA, Ciribilli Y. ETV7-Mediated DNAJC15 Repression Leads to Doxorubicin Resistance in Breast Cancer Cells. Neoplasia. 2018 Aug;20(8):857-870.
Pinazza M.*, Ghisi M.*, Minuzzo S., Agnusdei V., Fossati G., Ciminale V., Pezzè L., Ciribilli Y., Pilotto G., Venturoli C., Amadori A. and Indraccolo S. Histone deacetylase 6 controls Notch3 trafficking and degradation in T-cell Acute Lymphoblastyc Leukemia cells. Oncogene. 2018. Jul;37(28):3839-3851.
Ciribilli Y., Borlak J. Oncogenomics of c-Myc transgenic mice reveal novel regulators of extracellular signaling, angiogenesis and invasion with clinical significance for human lung adenocarcinoma. Oncotarget. 2017 Oct 23;8(60):101808-101831.
Bisio A., Zámborszky J., Zaccara S., Lion M., Tebaldi T., Sharma V., Raimondi I., Alessandrini F., Ciribilli Y.*, Inga A.*. Cooperative interactions between p53 and NFkB enhance cell plasticity. Oncotarget. 2014 Oct 21.
* = ugual contributo
